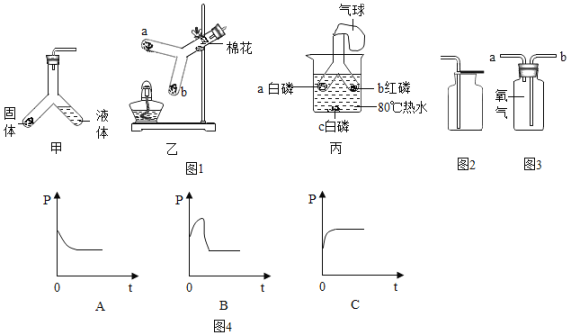
题目内容
【题目】钠及其化合物是中学化学学习和研究的重要内容.
(1)图1是钠元素在周期表中的信息和钠原子结构示意图.下列是某同学从图1获得的信息,错误的是_____(填标号).
a钠属于金属元素
b钠的相对原子质量为22.99g
c钠原子在化学反应中易得到电子
d![]() 表示原子核带11个单位正电荷
表示原子核带11个单位正电荷
(2)钠可以在水发生反应:2Na+2H2O═2NaOH+X↑,则X的化学式为_____.
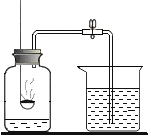
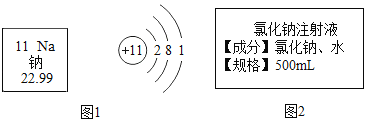
(3)配制一瓶图2所示的溶液,请问:
①需要称取氯化钠的质量为_____g,需加入水的体积为_____ mL;
②若用6%的氯化钠溶液加水稀释而成,则需6%氯化钠溶液的质量_____g.
(4)碳酸氢钠(NaHCO3)受热易分解生成碳酸钠、水和二氧化碳,写出该反应的化学方程式_____.
【答案】bc H2 4.5 495.5 75 2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
【解析】
最外层电子数少于4个,在反应中容易失去1个电子,碳酸氢钠分解可以得到碳酸钠、二氧化碳和水。
(1)a、钠属于金属元素,故a正确;
b、最下面的数值是相对原子质量,因此钠元素的相对原子质量是22.99,故b不正确;
c、钠原子的最外层电子数少于4个,在反应中容易失去1个电子,故c不正确;
d、原子核带11个单位的正电荷,故d正确。故选bc。
(2)根据反应的化学方程式![]() ,反应物中Na、H、O原子个数分别为2、4、2,反应后的生成物Na、H、O原子个数分别为2、2、2,根据反应前后原子种类、数目不变,则X中含有2个H原子,则物质X的化学式为H2。
,反应物中Na、H、O原子个数分别为2、4、2,反应后的生成物Na、H、O原子个数分别为2、2、2,根据反应前后原子种类、数目不变,则X中含有2个H原子,则物质X的化学式为H2。
(3)①需要称取氯化钠的质量为![]() ;需水:
;需水:
![]() ,即495.5mL水。
,即495.5mL水。
②设需要6%的氯化钠溶液的质量为x,则![]() ,x=75g,需6%氯化钠溶液的质量为75g。
,x=75g,需6%氯化钠溶液的质量为75g。
(4)碳酸氢钠分解可以得到碳酸钠、二氧化碳和水,反应的方程式为
![]() 。
。

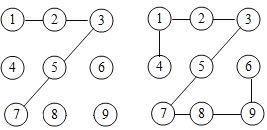
【题目】某实验小组的同学用碳酸钠粉末、碳酸钙粉末、块状大理石、稀盐酸、浓盐酸、稀硫酸这几种药品,探究哪些药品适合在实验室制取CO2.请你参与下列的探究并回答问题.
(提出问题)上述哪些物质间的反应适合在实验室制取CO2?
(方案设计)大家经过讨论,一致认为浓盐酸不适合用于实验室制取CO2,你认为原因是_____;讨论后大家设计了如下四个实验进行对比分析.
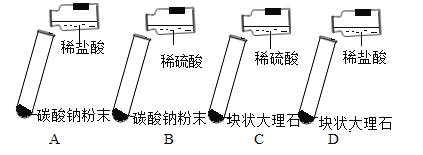
(实验与结论)
(1)请你填写实验报告中①、②处的内容.
实验 | 实验现象 | 实验内容 |
A | 剧烈反应,迅速放出大量气泡 | 反应速率过快,气体不便收集 |
B | 剧烈反应,迅速放出大量气泡 | 反应速率过快,气体不便收集 |
C | 产生气泡,速率迅速减慢,反应几乎停止 | 无法持续产生CO2 |
D | ①_____ | ②_____ |
(2)根据探究结论,实验室制取二氧化碳的药品是_____和_____,反应原理为_____ ( 用化学方程式表示);
(拓展与迁移)
(1)由上述探究可知,在确定实验室制取气体的反应原理时,要考虑诸多因素,例如反应速率要适中,便于收集等.请你再写出一种需要考虑的因素:_____;
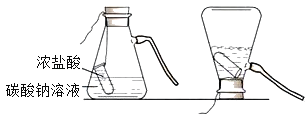
(2)如图是一种灭火器的工作原理示意图,其中用碳酸钠和浓盐酸反应来产生CO2的理由是_____.
【题目】分类、类比是学习化学常用的方法。
(1)初中化学实验可以按照实验目的分为:“物质含量的探究”、“探究反应条件实验”、“探究物质性质实验”等。据此我们可以将实验D 与实验①_____(填字母)分为一类,分类依据是②_____。
|
|
|
|
A | B | C | D |
(2)浓硫酸、稀硝酸和浓硝酸能和某些金属活动性弱的金属发生反应,如金属银能与稀硝酸、浓硝酸发生反应,其发生反应的化学方程式如下:3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O ,Ag+2HNO3(浓)═AgNO3+NO2↑+H2O金属铜也能与稀硝酸、浓硝酸发生类似的反应,结合上述信息,试写出铜与浓硝酸发生反应的化学方程式:①_____。在铜与浓硝酸的反应中,元素化合价发生改变的元素是②__(填元素符号)