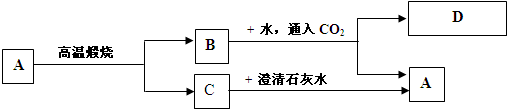
题目内容
A是一种白色难溶于水的钙盐,由三种元素组成,其相对分子质量为100.
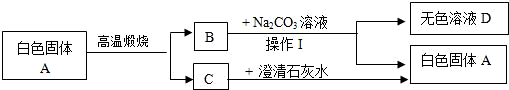
(1)用化学式表示:A________,B________(2)操作I的名称是________.
(3)D中含有的溶质可能有哪几种情况?(根据需要填写,可不填满,若不够也可添加)
①________②________③________
(4)小聪同学想检验D溶液中是否含Na2CO3,他取D溶液于试管中,滴入几滴稀盐酸,发现没有气泡产生,据此小聪认为D溶液中不含Na2CO3,你认为小聪同学的实验设计是否正确?请说明理由________.
解:(一)由于题目中A物质是相对分子质量为100的白色难溶性的物质,且是石灰水对应的生成物,还是Na2CO3对应的生成物,因此A为CaCO3.
(二)A为CaCO3,则BC就是CO2和CaO,由于C和石灰水反应生成沉淀,所以C为CO2,则B为CaO.B和Na2CO3溶液反应时,B先和水反应生成Ca(OH)2,之后和Na2CO3溶液反应,生成CaCO3和NaOH.
(三)(3)中D溶液中的可能溶质,分析时要对加入Na2CO3量考虑,由于没有明确说明,所以Na2CO3的量就有三种可能:①不足;②恰好反应;③过量.那么对应溶液中的溶质就有三种可能:①NaOH、Ca(OH)2(剩余的);②NaOH;③NaOH、Na2CO3(加多的).(4)中对于加入盐酸对NaCO3的检验,相信有(3)铺垫,大家一定能够想到我们加入的盐酸的量可能对结果的影响,由于无论是三种情况中的哪一种,溶液都显碱性,当加入的盐酸不足时,产生的二氧化碳就不会溢出.
故答案:
(1)CaCO3;BCaO
(2)过滤.
(3)①NaOH(加入的碳酸钠正好反应)
②NaOH、Ca(OH)2(加入的碳酸钠偏少)
③NaOH、Na2CO3(加入的碳酸钠过量)
(4)不正确,由于溶液是碱性的,加少量的HCl,即使有Na2CO3存在也不会产生气泡.
分析:这道题目给予解题信息很丰富,无论是相对分子质量为100,还是澄清石灰水对应的白色沉淀都在告诉我们CaCO3的真是存在.通过放在题目中的验证,可以确保A就是CaCO3.
点评:对于实验,操作中很简单的操作,也会有不同的实验结果,所以在考查实验时要注意对操作细节或者措词的考究.
(二)A为CaCO3,则BC就是CO2和CaO,由于C和石灰水反应生成沉淀,所以C为CO2,则B为CaO.B和Na2CO3溶液反应时,B先和水反应生成Ca(OH)2,之后和Na2CO3溶液反应,生成CaCO3和NaOH.
(三)(3)中D溶液中的可能溶质,分析时要对加入Na2CO3量考虑,由于没有明确说明,所以Na2CO3的量就有三种可能:①不足;②恰好反应;③过量.那么对应溶液中的溶质就有三种可能:①NaOH、Ca(OH)2(剩余的);②NaOH;③NaOH、Na2CO3(加多的).(4)中对于加入盐酸对NaCO3的检验,相信有(3)铺垫,大家一定能够想到我们加入的盐酸的量可能对结果的影响,由于无论是三种情况中的哪一种,溶液都显碱性,当加入的盐酸不足时,产生的二氧化碳就不会溢出.
故答案:
(1)CaCO3;BCaO
(2)过滤.
(3)①NaOH(加入的碳酸钠正好反应)
②NaOH、Ca(OH)2(加入的碳酸钠偏少)
③NaOH、Na2CO3(加入的碳酸钠过量)
(4)不正确,由于溶液是碱性的,加少量的HCl,即使有Na2CO3存在也不会产生气泡.
分析:这道题目给予解题信息很丰富,无论是相对分子质量为100,还是澄清石灰水对应的白色沉淀都在告诉我们CaCO3的真是存在.通过放在题目中的验证,可以确保A就是CaCO3.
点评:对于实验,操作中很简单的操作,也会有不同的实验结果,所以在考查实验时要注意对操作细节或者措词的考究.

练习册系列答案
相关题目


 (2012?乐山)A、B、C、D都是初中化学中的常见物质,具有如图所示的转化关系(反应条件、有些反应物或产物已略去):
(2012?乐山)A、B、C、D都是初中化学中的常见物质,具有如图所示的转化关系(反应条件、有些反应物或产物已略去):