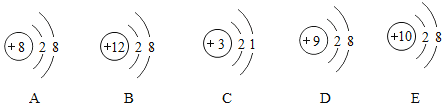
��Ŀ����
����Ŀ��ʵ���ҳ��õĸ��������ʯ�ҡ��������ƺ����������ƵĻ�����������е�ˮ�����Ͷ�����̼��Ӧ�����ʡ�ijͬѧ��һƿ���õļ�ʯ�ҽ���������̽����
����������衿
����һ��û�б��ʣ�ֻ���������ƺ��������ƣ�
����������ֱ��ʣ�
����������ȫ���ʣ�����______________��______________��
���������Ʊ��ʵĻ�ѧ��Ӧ����ʽ��______________________________��
������ʵ�顿
ʵ������ͼ��ʾ��
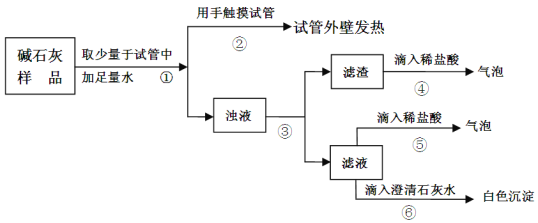
����������ۡ�
�ɲ������������жϣ�������______________����������������������ɲ����ݢ��������ж���Һ�к���_____________���ɴ��жϲ���һ���������ó����ۡ�
����˼�����ۡ�ʵ�����м�ʯ��Ӧ��______________���档
���𰸡�CaCO3(����Ҳ��)��Na2CO3 (����Ҳ��)��2NaOH+CO2= Na2CO3+ H2O �������� ��Na2CO3 �� �ܷ�
��������
�������������������Ϊ������������е�ˮ��Ӧ�����������ƣ�������������������еĶ�����̼��Ӧ����̼��ƺ�ˮ���������ƾ�����ˮ�ԣ�Ҳ��������еĶ�����̼��Ӧ����̼���ƺ�ˮ���������ƺ�̼����Ҳ��������̼��Ƴ������������ƣ�����ȫ���ʣ����ʯ���к���̼��ƺ�̼���ƣ��������Ʊ��ʵĻ�ѧ��Ӧ����ʽ��2NaOH+CO2= Na2CO3+ H2O������������ۡ���Ϊ��ˮ��ų�������˵����ʯ������Ȼ���������ƻ��������ƻ���߶��У����������۲���������Ϊ̼��Ʋ�����ˮ����Һ�в����ݢ����������������岢�������ʯ��ˮ����������������̼���ƣ�����һ������������һ�Ͳ�����������������ó����ۣ���������������ֱ��ʣ�����˼�����ۡ���ʯ����������е�ˮ��������̼�����ʷ�Ӧ����Ӧ���ܷⱣ��