题目内容
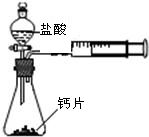
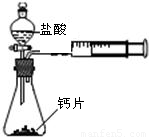
某校化学兴趣小组为了准确测定某石料中碳酸钙的质量分数,他们先将石料粉碎,然后称取3份,分别逐渐加入到3份稀盐酸中(石料中的杂质不参加反应),待反应停止后,所测数据记录如下表:
分析表中数据,计算:
(1)50g石料恰好完全反应时,消耗稀盐酸的质量是
(2)该石料中碳酸钙的质量分数;
(3)恰好完全反应时所得溶液中溶液中溶质质量分数(结果精确的0.1%).
| 1 | 2 | 3 | |
| 石料质量/g | 50 | 50 | 100 |
| 稀盐酸质量/g | 240 | 300 | 200 |
| CO2气体质量/g | 17.6 | 17.6 | 17.6 |
(1)50g石料恰好完全反应时,消耗稀盐酸的质量是
200
200
g;(2)该石料中碳酸钙的质量分数;
(3)恰好完全反应时所得溶液中溶液中溶质质量分数(结果精确的0.1%).
分析:(1)根据第1次实验和第3次实验进行比较进行分析;(3)根据二氧化碳的质量计算出碳酸钙的质量,再用碳酸钙的质量除以样品的质量即可.
解答:解:(1)第1次和第2次实验比较可知50g石料完全反应只能生成17.6g二氧化碳,再根据第1次实验和第3次实验进行比较,可知50g石料完全反应生成17.6g二氧化碳,所以第4次是按照100g稀盐酸反应制取17.6g二氧化碳,所以50g石料恰好完全反应时,消耗稀盐酸的质量是200g;
(2)解:设石料中CaCO3的质量为x,生成的氯化钙质量是y.
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 111 44
x y 17.6g
=
=
解得:x=40g y=44.4g
故CaCO3的质量分数=
×100%=80.0%
恰好反应时需要的盐酸的质量是200g,故此时溶液的溶质质量分数为:
×100%≈20.0%
故答案为:(1)200g;(3)答:石料中CaCO3的质量分数为80.0%.(3)第一份反应后所得溶液中溶液中溶质质量分数约为20.0%.
(2)解:设石料中CaCO3的质量为x,生成的氯化钙质量是y.
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 111 44
x y 17.6g
| 100 |
| x |
| 44 |
| 17.6g |
| 111 |
| y |
解得:x=40g y=44.4g
故CaCO3的质量分数=
| 40g |
| 50g |
恰好反应时需要的盐酸的质量是200g,故此时溶液的溶质质量分数为:
| 44.4g |
| 40g+200g-17.6g |
故答案为:(1)200g;(3)答:石料中CaCO3的质量分数为80.0%.(3)第一份反应后所得溶液中溶液中溶质质量分数约为20.0%.
点评:本题是对化学方程式计算的综合考查题,根据质量守恒定律,反应后所得溶液的质量=碳酸钙的质量+所加稀盐酸的总质量-放出二氧化碳气体的质量是解题的关键.

练习册系列答案
相关题目
 某校化学兴趣小组为了测定某一碳酸钠样品中碳酸钠的质量分数,进行如下实验,取13.25g碳酸钠样品(杂质既不溶于酸也不溶于水)放入烧杯中,加入95.8g水使其完全溶解,再向其中加入稀硫酸,测得反应放出气体的总质量与所加入稀硫酸的质量关系曲线如右图所示,请根据题意解答问题:
某校化学兴趣小组为了测定某一碳酸钠样品中碳酸钠的质量分数,进行如下实验,取13.25g碳酸钠样品(杂质既不溶于酸也不溶于水)放入烧杯中,加入95.8g水使其完全溶解,再向其中加入稀硫酸,测得反应放出气体的总质量与所加入稀硫酸的质量关系曲线如右图所示,请根据题意解答问题: