题目内容
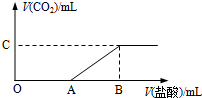 标准状况下,向100mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后得溶液M(无CO2存在).在溶液M中逐滴缓慢滴加1mol/L盐酸,生成气体的体积与所加盐酸的体积关系如图所示:
标准状况下,向100mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后得溶液M(无CO2存在).在溶液M中逐滴缓慢滴加1mol/L盐酸,生成气体的体积与所加盐酸的体积关系如图所示:已知:
①向NaOH和Na2CO3的混合溶液中逐滴缓慢滴加盐酸时,依次发生的反应是:
NaOH+HCl═NaCl+H2O
Na2CO3+HCl═NaCl+NaHCO3(无气体生成)
NaHCO3+HCl═NaCl+CO2↑+H2O
②图中B点位置固定,且V(B)=300,而点A、C可在各自的轴上移动.试回答下列问题:
(1)原NaOH溶液的物质的量浓度为
3
3
mol/L,B点时,最终所得溶液中的溶质的物质的量浓度是0.75
0.75
mol/L(两种溶液混合时假设体积可以直接相加)(2)V(A)的取值不同时,溶液M中的溶质的成分也不同,请填写下表:
| V(A)的取值 | V(A)=0 | 0<V(A)<150 | V(A)=150 | 150<V(A)<300 |
| 溶质的成分 (填写化学式) |
① NaHCO3 NaHCO3 |
② Na2CO3和NaHCO3 Na2CO3和NaHCO3 |
③ Na2CO3 Na2CO3 |
④ NaOH和Na2CO3 NaOH和Na2CO3 |
2240
2240
.分析:(1)反应消耗的稀盐酸的物质的量可以计算出氢氧化钠的物质的量,并根据反应的化学方程式求出B点时生成的氯化钠的物质的量,然后求出其溶液中物质的量浓度即可;
(2)根据碳酸钠及氢氧化钠与盐酸反应的化学方程式结合题中所给的信息可以完成解答.
(2)根据碳酸钠及氢氧化钠与盐酸反应的化学方程式结合题中所给的信息可以完成解答.
解答:解:(1)300mL=0.3L 100mL=0.1L
根据题中信息可以知道至B点时发生的反应为:
2NaOH+CO2═Na2CO3+H2O
NaOH+HCl═NaCl+H2O
Na2CO3+HCl═NaCl+NaHCO3
NaHCO3+HCl═NaCl+CO2↑+H2O
由此可以的关系式为:NaOH-HCl-NaCl
反应过程中消耗盐酸的物质的量为:1mol/L×0.3L=0.3mol
设氢氧化钠的物质的量为x,生成氯化钠的物质的量为y
NaOH-HCl-NaCl
1 1 1
x 0.3mol y
=
=
解得:x=0.3mol y=0.3mol
所以氢氧化钠溶液的物质的量浓度为:
=3mol/L
B点时,最终所得溶液中的溶质的物质的量浓度为:
=0.75mol/L
(2)根据题中所给的反应的化学方程式可以知道,与碳酸钠和碳酸氢钠反应的稀盐酸的物质的量为1:1,而B点时消耗盐酸的体积为300mL,所以V(A)=150mL时对应溶质为Na2CO3,根据钠离子守恒可知各自的物质的量均为0.1mol,如果V(A)=0,即滴入稀盐酸即产生二氧化碳,所以可以判断M溶液中的溶质为碳酸氢钠;当0<V(A)<150,溶液中溶质为碳酸钠和碳酸氢钠的混合物,若A点稀盐酸的体积大于了150mL,则可以判断在溶液中还含有氢氧化钠,即150<V(A)<300时,M溶液中的溶质为碳酸钠和氢氧化钠.
若果V(A)=200mL,则与碳酸氢钠反应的稀盐酸的体积为100mL,即 盐酸的物质的量为:1mol/L×0.1L=0.1mol
设生成二氧化碳的物质的量为z
NaHCO3+HCl═NaCl+CO2↑+H2O
1 22.4L
0.1mol V
=
解得:V=2.24L=2240mL
故答案为:(1)3;0.75;
(2)①NaHCO3②Na2CO3和NaHCO3③Na2CO3④NaOH和Na2CO3;2240.
根据题中信息可以知道至B点时发生的反应为:
2NaOH+CO2═Na2CO3+H2O
NaOH+HCl═NaCl+H2O
Na2CO3+HCl═NaCl+NaHCO3
NaHCO3+HCl═NaCl+CO2↑+H2O
由此可以的关系式为:NaOH-HCl-NaCl
反应过程中消耗盐酸的物质的量为:1mol/L×0.3L=0.3mol
设氢氧化钠的物质的量为x,生成氯化钠的物质的量为y
NaOH-HCl-NaCl
1 1 1
x 0.3mol y
| 1 |
| x |
| 1 |
| y |
| 1 |
| 0.3mol |
解得:x=0.3mol y=0.3mol
所以氢氧化钠溶液的物质的量浓度为:
| 0.3mol |
| 0.1L |
B点时,最终所得溶液中的溶质的物质的量浓度为:
| 0.3mol |
| 0.1L+0.3L |
(2)根据题中所给的反应的化学方程式可以知道,与碳酸钠和碳酸氢钠反应的稀盐酸的物质的量为1:1,而B点时消耗盐酸的体积为300mL,所以V(A)=150mL时对应溶质为Na2CO3,根据钠离子守恒可知各自的物质的量均为0.1mol,如果V(A)=0,即滴入稀盐酸即产生二氧化碳,所以可以判断M溶液中的溶质为碳酸氢钠;当0<V(A)<150,溶液中溶质为碳酸钠和碳酸氢钠的混合物,若A点稀盐酸的体积大于了150mL,则可以判断在溶液中还含有氢氧化钠,即150<V(A)<300时,M溶液中的溶质为碳酸钠和氢氧化钠.
若果V(A)=200mL,则与碳酸氢钠反应的稀盐酸的体积为100mL,即 盐酸的物质的量为:1mol/L×0.1L=0.1mol
设生成二氧化碳的物质的量为z
NaHCO3+HCl═NaCl+CO2↑+H2O
1 22.4L
0.1mol V
| 1 |
| 0.1mol |
| 22.4 |
| V |
解得:V=2.24L=2240mL
故答案为:(1)3;0.75;
(2)①NaHCO3②Na2CO3和NaHCO3③Na2CO3④NaOH和Na2CO3;2240.
点评:本题考查混合物的计算,题目难度中等,注意从图象分析反应可能的情况进行判断和计算,本题关键是根据图象判断溶液溶质的成分.

练习册系列答案
相关题目
下表是三种气体的密度(单位:g/L,在标准状况下测定)和溶解度(克/100克水,在20℃、101.3Pa的条件下测定)
|
下表是三种气体的密度(单位:g/L,在标准状况下测定)和溶解度(克/100克水,在20℃、101.3Pa的条件下测定)
实验室要收集SO2气体,可采用的方法是( )
A.向上排空气法
B.向下排空气法
C.排水法
D.既可用排水法,又可用向上排空气法
| H2 | CO2 | SO2 | |
| 密度(g/L) | 0.08987 | 1.975 | 2.716 |
| 溶解度(克/100克水) | 0.0001603 | 0.1688 | 11.28 |
A.向上排空气法
B.向下排空气法
C.排水法
D.既可用排水法,又可用向上排空气法