题目内容
5.6g铁粉与100g某硫酸铜溶液恰好完全反应.求这种硫酸铜溶液中溶质的质量分数.
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算,有关溶液溶质质量分数的计算
分析:根据铁与硫酸铜反应的方程式以及铁的质量,列比例式即可求得反应生成的硫酸铜的质量;利用
×100%即可求得硫酸铜溶液的溶质质量分数.
| 溶质质量 |
| 溶液质量 |
解答:解:设参加反应的硫酸铜的质量为x
Fe+CuSO4═FeSO4+Cu
56 160
5.6g x
=
x=16g
根据质量分数公式,硫酸铜溶液中溶质的质量分数为:
×100%=16%
答案:硫酸铜溶液中溶质的质量分数为16%
Fe+CuSO4═FeSO4+Cu
56 160
5.6g x
| 56 |
| 160 |
| 5.6g |
| x |
x=16g
根据质量分数公式,硫酸铜溶液中溶质的质量分数为:
| 16g |
| 100g |
答案:硫酸铜溶液中溶质的质量分数为16%
点评:本题考查了质量分数的计算以及根据化学方程式的简单计算,写好化学方程式是解题的关键.注意化学变化都遵循质量守恒定律,质量守恒定律的灵活使用,对于解答此类问题会有很大帮助,甚至起到决定性作用.

练习册系列答案
相关题目
某密闭容器中有X、氧气和二氧化碳三种物质,在一定条件下充分反应,测得反应前后各物质的质量如表.根据表中信息,判断下列说法正确的是( )
| 物质 | X | O2 | CO2 | H2O |
| 反应前质量/g | 16 | 70 | 1 | 0 |
| 反应后质量/g | 0 | 待测 | 45 | 36 |
| A、表中“待测”值为5 |
| B、反应生成的CO2和H2O的质量比为45:36 |
| C、X中一定含有碳、氢两种元素 |
| D、反应的化学方程式中O2与CO2的化学计量数之比为2:1 |
化学反应有不同的分类方法.关于对下列反应的分类错误的是( )
A、8Al+3Fe3O4
| ||||
B、C+O2
| ||||
| C、NaOH+HCl═NaCl+H2O属于中和反应 | ||||
D、CaCO3
|



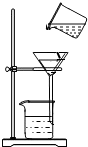 某同学将浑浊的湖水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静止一会,采用如图所示装置进行过滤.请问:
某同学将浑浊的湖水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静止一会,采用如图所示装置进行过滤.请问:
