题目内容
(2011?石景山区二模)铁、铜和银是日常生活中经常接触到的三种金属.(1)三种金属共同具有的物理性质是______(写出一条即可).
(2)若要证明铁、铜和银的活动性顺序,需要进行的实验有______(填序号).
A.将铁片放入盐酸中 B.将铜片放入盐酸中
C.将铁片放入硝酸银溶液中 D.将铜片放入硝酸银溶液中
(3)氧化铁是一种红褐色的固体粉末.请根据下图回答问题.
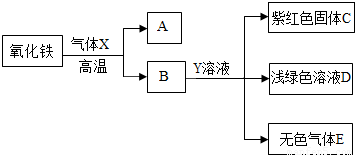
①写出气体X与氧化铁反应的化学方程式______ 2Fe+3CO2
【答案】分析:(1)根据金属物理性质的共同,对三种金属物理相似处进行回答;
(2)根据三种金属的活动性强弱关系,分析所设计实验对检验活动性的作用,判断可以检验三种金属活动性顺序的实验组合;
(3)利用物质或溶液的颜色及关系框图,推断所涉及的物质,写出所涉及反应的化学方程式及判断溶液中可能的溶质;
(4)图示的曲线表明,随着x的增加y的质量开始增大,至一定量时不再改变.
解答:解:(1)金属都具有良好的导热性、导电性及延展性;
(2)A.将铁片放入盐酸中,可说明铁在金属活动顺序中位于氢之前;B.将铜片放入盐酸中,可说明铜在金属活动顺序中位于氢之后;C.将铁片放入硝酸银溶液中,可说明铁的活动性比银强;D.将铜片放入硝酸银溶液中,可说明铜的活动性比银强;因此,要证明铁、铜和银的活动性顺序,需要进行ABD三个实验;
(3)根据氧化铁在高温下能与还原性气体一氧化碳或氢气反应生成铁,可判断气体X为一氧化碳或氢气;根据铁与可溶性铜盐、酸发生置换反应,结合框图关系,物质B能与溶液Y反应得到紫红色C固体铜、浅绿色的亚铁盐溶液及无色气体E,可推断物质B为还原后所得到的铁,而溶液Y为硫酸铜(或氯化铜)与酸(硫酸或盐酸)的混合溶液,气体E为氢气,则气体X为一氧化碳;因此①气体X与氧化铁反应的化学方程式3CO+Fe2O3 2Fe+3CO2,②Y溶液中的溶质为CuSO4(或CuCl2)和H2SO4(或HCl),
2Fe+3CO2,②Y溶液中的溶质为CuSO4(或CuCl2)和H2SO4(或HCl),
③生成无色气体E的化学方程式为Fe+H2SO4═FeSO4+H2↑(或Fe+2HCl═FeCl2+H2↑);
(4)A、随着铁粉质量增加,反应得到硫酸亚铁质量小于原硫酸铜溶液质量,因此溶液质量会逐渐减小至完全反应而不变;与曲线所示不符;
B、随着铁粉质量增加,析出铜粉的质量应从0开始增加,与曲线所示不符;
C、随反应时间延长,生成硫酸亚铁质量也应从0开始增加,与曲线所示不符;
D、由于等质量铁所置换出铜的质量大于所消耗铁粉质量,因此,随反应时间延长,固体质量逐渐增加至完全反应不再改变;与曲线所示相符;
故答案为:
(1)导热性(或导电性、延展性等);
(2)ABD;
(3)①3CO+Fe2O3 2Fe+3CO2;
2Fe+3CO2;
②CuSO4(或CuCl2)和H2SO4(或HCl);
③Fe+H2SO4═FeSO4+H2↑(或Fe+2HCl═FeCl2+H2↑);
(4)D.
点评:在分析表示变化的曲线时,曲线的起点、折点及趋势的特殊意义是我们分析时必需重点关注的对象.
(2)根据三种金属的活动性强弱关系,分析所设计实验对检验活动性的作用,判断可以检验三种金属活动性顺序的实验组合;
(3)利用物质或溶液的颜色及关系框图,推断所涉及的物质,写出所涉及反应的化学方程式及判断溶液中可能的溶质;
(4)图示的曲线表明,随着x的增加y的质量开始增大,至一定量时不再改变.
解答:解:(1)金属都具有良好的导热性、导电性及延展性;
(2)A.将铁片放入盐酸中,可说明铁在金属活动顺序中位于氢之前;B.将铜片放入盐酸中,可说明铜在金属活动顺序中位于氢之后;C.将铁片放入硝酸银溶液中,可说明铁的活动性比银强;D.将铜片放入硝酸银溶液中,可说明铜的活动性比银强;因此,要证明铁、铜和银的活动性顺序,需要进行ABD三个实验;
(3)根据氧化铁在高温下能与还原性气体一氧化碳或氢气反应生成铁,可判断气体X为一氧化碳或氢气;根据铁与可溶性铜盐、酸发生置换反应,结合框图关系,物质B能与溶液Y反应得到紫红色C固体铜、浅绿色的亚铁盐溶液及无色气体E,可推断物质B为还原后所得到的铁,而溶液Y为硫酸铜(或氯化铜)与酸(硫酸或盐酸)的混合溶液,气体E为氢气,则气体X为一氧化碳;因此①气体X与氧化铁反应的化学方程式3CO+Fe2O3
 2Fe+3CO2,②Y溶液中的溶质为CuSO4(或CuCl2)和H2SO4(或HCl),
2Fe+3CO2,②Y溶液中的溶质为CuSO4(或CuCl2)和H2SO4(或HCl),③生成无色气体E的化学方程式为Fe+H2SO4═FeSO4+H2↑(或Fe+2HCl═FeCl2+H2↑);
(4)A、随着铁粉质量增加,反应得到硫酸亚铁质量小于原硫酸铜溶液质量,因此溶液质量会逐渐减小至完全反应而不变;与曲线所示不符;
B、随着铁粉质量增加,析出铜粉的质量应从0开始增加,与曲线所示不符;
C、随反应时间延长,生成硫酸亚铁质量也应从0开始增加,与曲线所示不符;
D、由于等质量铁所置换出铜的质量大于所消耗铁粉质量,因此,随反应时间延长,固体质量逐渐增加至完全反应不再改变;与曲线所示相符;
故答案为:
(1)导热性(或导电性、延展性等);
(2)ABD;
(3)①3CO+Fe2O3
 2Fe+3CO2;
2Fe+3CO2;②CuSO4(或CuCl2)和H2SO4(或HCl);
③Fe+H2SO4═FeSO4+H2↑(或Fe+2HCl═FeCl2+H2↑);
(4)D.
点评:在分析表示变化的曲线时,曲线的起点、折点及趋势的特殊意义是我们分析时必需重点关注的对象.

练习册系列答案
相关题目
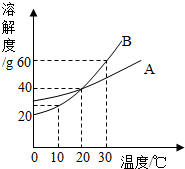 (2011?石景山区一模)A和B两种固体的溶解度曲线如右图所示.下列说法中,正确的是( )
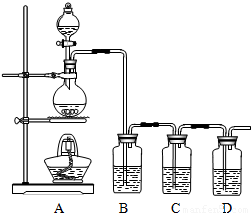
(2011?石景山区一模)A和B两种固体的溶解度曲线如右图所示.下列说法中,正确的是( ) CO2↑+2SO2↑+2H2O.为了证明木炭与浓硫酸反应有二氧化碳和二氧化硫生成,甲、乙两位同学分别用下面的装置进行实验.实验中甲同学在C中盛放足量的饱和碳酸氢钠溶液,乙同学在C中盛放足量的酸性高锰酸钾溶液,两位同学在其他装置中盛放的药品相同且适量.
CO2↑+2SO2↑+2H2O.为了证明木炭与浓硫酸反应有二氧化碳和二氧化硫生成,甲、乙两位同学分别用下面的装置进行实验.实验中甲同学在C中盛放足量的饱和碳酸氢钠溶液,乙同学在C中盛放足量的酸性高锰酸钾溶液,两位同学在其他装置中盛放的药品相同且适量.