题目内容
(2009?普陀区一模)1.42gR元素可与氧元素组成2.38g氧化物X,或组成3.66g氧化物Y.则X、Y的化学式可能为( )
【答案】分析:根据两种氧化物中R元素质量与氧化物的质量,可得出两物质中元素R与氧元素的质量比;由于O元素呈-2价,通过假设两物质的化学式分别是R2Oa和R2Ob,建立方程组计算出两种物质的化学式中a、b的比;根据a、b的比判断选项中最接近的答案.
解答:解:设R元素的原子量为x,组成的氧化物化学式分别是R2Oa和R2Ob.则有:
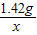 :
: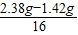 =2:a
=2:a
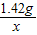 :
: =2:b
=2:b
可解得a:b=11:28,约等于3:7;即物质X、Y中元素R的质量相等时,两物质中氧元素的原子个数比为3:7,故C最为可能;
故选C.
点评:根据本题所提供的四个选项,依次利用所给出的化学式计算出R元素的相对原子质量;由两种物质化学式计算出的R元素相对原子质量相等或最接近的一组,为正确结果.
解答:解:设R元素的原子量为x,组成的氧化物化学式分别是R2Oa和R2Ob.则有:
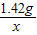 :
: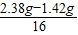 =2:a
=2:a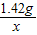 :
: =2:b
=2:b可解得a:b=11:28,约等于3:7;即物质X、Y中元素R的质量相等时,两物质中氧元素的原子个数比为3:7,故C最为可能;
故选C.
点评:根据本题所提供的四个选项,依次利用所给出的化学式计算出R元素的相对原子质量;由两种物质化学式计算出的R元素相对原子质量相等或最接近的一组,为正确结果.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目