题目内容
【题目】向盛有26.4g硫酸钠和碳酸钠混合物的烧杯中加入218g稀硫酸,恰好完全反应,固体全部消失,烧杯内物质总质量减少了4.4g.(化学反应方程式为Na2CO3+H2SO4═Na2SO4+H2O+CO2↑),请计算:
(1)原混合物中碳酸钠的质量.
(2)反应后所得溶液中溶质的质量分数.
【答案】
(1)解:设固体混合物中碳酸钠的质量为x,生成的硫酸钠的质量为y
Na2CO3+H2SO4= | Na2SO4+H2O+ | CO2↑ |
106 | 142 | 44 |
x | y | 4.4g |
![]()
解得:x=10.6g y=14.2g
答:固体混合物中碳酸钠的质量为10.6g;
(2)解:反应后所得溶液中溶质的质量分数: ![]() =12.5%.
=12.5%.
答:反应后所得溶液中溶质的质量分数为12.5%.
【解析】解:(1)设固体混合物中碳酸钠的质量为x,生成的硫酸钠的质量为y
Na2CO3+H2SO4= | Na2SO4+H2O+ | CO2↑ |
106 | 142 | 44 |
x | y | 4.4g |
![]()
解得:x=10.6g y=14.2g
(1)根据质量守恒定律,物质的总质量减少的质量就是生成的二氧化碳的质量;根据碳酸钠与硫酸的反应,由二氧化碳的质量可求出反应的碳酸钠的质量、生成的硫酸钠的质量;(2)根据碳酸钠的质量可求出原混合物中硫酸钠的质量,即可求出反应后溶液中溶质硫酸钠的质量.

【题目】选修课上,某化学兴趣小组在老师的帮助下,开展了以下的相关探究:
(1)探究一:氢气的燃烧实验 
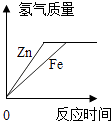
①用锌和稀硫酸制取氢气,从图甲中选择仪器组装一套随开随停的发生装置,所需仪器为(填编号);反应的化学方程式为 .
②按图乙操作研究氢气的燃烧实验,需用试管收集不同体积比的氢气与空气的混合物,现用①中组装的正确装置制取氢气,如何用试管(假设试管容积为10mL)收集氢气与空气体积比为4:1的混合气体,写出其操作方法: .
③用不同体积比的混合气体做氢气的燃烧实验,结果如表:
序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
氢气与空气体积比 | 9:1 | 8:2 | 7:3 | 5:5 | 3:7 | 1:9 | 0.5:9.5 |
点燃现象 | 安静 | 安静 | 弱的 | 强的 | 强的 | 弱的 | 不燃烧 |
分析上表信息,你对燃烧或燃烧条件的新认识是 .
(2)探究二:该化学兴趣小组的同学们在一次课外实验中发现一种淡黄色的粉末可以杀菌、消毒和漂白,于是想探究该固体的成分. 提出问题]该淡黄色固体的化学成分是什么?
[查阅资料]
①硫单质是一种淡黄色固体,难溶于水.在空气中点燃硫单质,生成一种无色、有刺激性气味的气体.
②过氧化钠(Na2O2)是一种淡黄色固体,能与水反应,生成气体并放出大量的热.
[设计实验方案]
方案一:取少量该固体粉末于试管中,加2mL水,振荡并观察现象.
方案二:在燃烧匙里放少量该固体,在酒精灯上加热,观察现象.
比较以上两方案,你认为的最佳方案是 , 理由是(从环保或操作角度分析) .
(3)[实验验证并得出结论] 兴趣小组中甲同学向盛有少量该固体的试管中加入2mL水,立刻观察到有无色气泡产生,并且验证出该反应同时生成了氢氧化钠(NaOH).通过实验验证,确定该淡黄色粉末为过氧化钠.甲同学对生成的气体成分判断.他提出了以下三种假设:①该气体是CO②该气体是O2 .
你认为上述假设哪个更合理(填“①”、“②”或“③”);理由是 .
(4)[分析]过氧化钠与水反应的化学方程式为 .
(5)[交流讨论]兴趣小组中乙同学在查阅资料时发现过氧化钠还能与二氧化碳反应,产生一种无色气体.为了验证该结论,该小组同学用图丙所示的装置进行实验,一段实验后,将带火星的木条伸入试管中,发现木条复燃.(温馨提示两点:a.浓硫酸具有吸水性;b.氢氧化钠溶液能与二氧化碳反应.) B装置能否省去?你的理由是;D装置中的氢氧化钠溶液的作用是 .