题目内容
【题目】(5分)粗盐中含有MgCl2、CaCl2等杂质,工业提纯粗盐的工艺流程如下图所示:
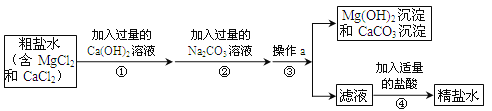
(1)步骤①反应的化学方程式为 。
(2)步骤③操作a的名称是 ,该操作中玻璃棒的作用是____________
(3)滤液中加稀盐酸发生中和反应方程式 。
(4)若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有 。
【答案】(1)Ca(OH)2+MgCl2===Mg(OH)2↓ +CaCl2
(2)过滤 引流
(3)NaOH+HCl===NaCl+H2O
(4)CaCl2或CaCl2和NaCl
【解析】
试题分析:(1)步骤①反应为:Ca(OH)2+MgCl2===Mg(OH)2↓+CaCl2
(2)氢氧化钙与氯化镁反应,生成氢氧化镁沉淀和氯化钙;碳酸钠能除去过量的碳酸钠,同时能除去氯化钙,操作a为过滤,将沉淀与溶液分离,玻璃棒的作用是引流;
(3)碳酸钠与与氢氧化钙反应,生成碳酸钙和氢氧化钠,则滤液中氢氧化钠与稀盐酸反应,生成氯化钠和水;
(4)若步骤①和步骤②的顺序颠倒,滤液中会含有氢氧化钠和氯化钙,向滤液中加入稀盐酸后,氢氧化钠与稀盐酸反应,而氯化钙不与稀盐酸反应,则最后所得的精盐水中还含有氯化钙。

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目