��Ŀ����
����Ŀ��������������ͼ��ش�
ͼһ ͼ�� ͼ��
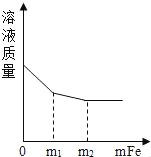
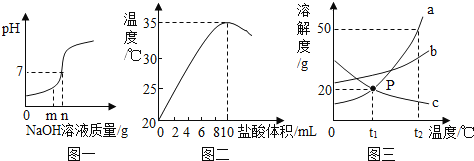
��1��ͼһ����������������ƽ����кͷ�Ӧʱ����Ӧ��������Һ��pH�仯���ߣ��������м��������������Һ����Ϊmgʱ��������Ӧ�Ļ�ѧ����ʽ��_____��������Һ�к��е���Ϊ_____���������ţ���
��2��ͼ����20��ʱ��ȡ10mL10%��NaOH��Һ���ձ��У���μ���10%�����ᣬ��������ļ��룬�ձ�����Һ�¶��������������ı仯��ϵ
����ͼ��֪�кͷ�Ӧ�Ƿ��ȷ�Ӧ���������Ϊ_____��
����ͬѧ���������ƹ�����ϡ���ᷴӦҲ�ܵõ���ͬ���ۣ���ͬѧ��Ϊ�����ܣ���Ϊ_____��
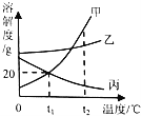
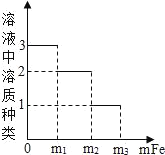
��3��ͼ����a��b��c�������ʵ��ܽ�����ߣ�a��c���ܽ���ཻ��P�㣬��ͼ�ش�
��t1��ʱ���ӽ����͵�c������Һ���ڲ��ı���Һ�����������£�����_____�ķ����ﵽ����״̬��
����t2��ʱ��150g a���ʵı�����Һ���µ�t1��ʱ����������_____g a���ʣ�
��t1��ʱ���ֱ�ȡ100g a�ı�����Һ��200g c�ı�����Һ��������10ˮ����������������ֱ�Ϊmg��ng����m��n�Ĺ�ϵ�ǣ�m_____n���������������������
���𰸡�HCl+NaOH��NaCl+H2O Na+��Cl����H+ ��ʼ���ŷ�Ӧ�Ľ��У���Һ�¶������� �������ƹ�������ˮ���� ���� 30 ��
��������
��1���������������Ʒ�Ӧ�����Ȼ��ƺ�ˮ���ʷ�Ӧ�Ļ�ѧ����ʽдΪ��HCl+NaOH=NaCl+H2O��
��ͼ��֪���������м��������������Һ����Ϊmgʱ����ҺΪ���ԣ������������Һ������Ϊ�Ȼ��ƺ��Ȼ��⣬������Һ�к��е�����ΪNa+��Cl����H+������Na+��Cl����H+��
��2������ͼ��֪�����ŷ�Ӧ�Ľ��У���Һ�¶������ߣ�˵���кͷ�Ӧ�Ƿ��ȷ�Ӧ������ʼ���ŷ�Ӧ�Ľ��У���Һ�¶������ߣ�
���������ƹ�������ˮ���ȣ���˵���кͷ�Ӧ�Ƿ��ȷ�Ӧ�������������ƹ�������ˮ���ȡ�
��3����c���ʵ��ܽ�����¶����߶���С���ڲ��ı���Һ�����������£�c�IJ�������Һ��ͨ������ʹ��������Һ��Ϊ������Һ���������£�
����t2��ʱ��a���ܽ����50�ˣ�����100��ˮ������ܽ�50��a���γ�150�˱�����Һ����150�˱�����Һ��Ӧ����50��a��100��ˮ����150�˱�����Һ������t1��ʱ��a���ܽ����20�ˣ���100��ˮ������ܽ�20�����ʣ���˽���֮����������������Ϊ50��20��=30�ˣ�����30��
����ͼ��֪��t1��ʱa��c���ܽ����ͬ���ֱ�100ga������Һ��200gc������Һ������10gˮ�������ľ��������ֱ�Ϊmg��ng������������ˮ��������ȣ�������������������ȣ������

����Ŀ������������ǵ���Ϣ���������Ϣ�ش����⣺
���� | ���� | ������ | ���� | ���� |
��ѧʽ | C5H10O5 | C6H12O6 | C12H22O11 | ��C6H10O5��n |
�ֲ����� | ��ϸ�� | ���� | ���� | �� |
����� ��ÿ100�ˣ� | ������1.5g | ��������30g | ������17g | ������77.6g |
��1��������_____Ԫ����ɡ�
��2����������_____����������������������
��3��10g���������ṩ15.6kJ������ijͬѧһ�����200g���ѣ������յ�����Ϊ_____kJ
��4����Ȼ���У�ֲ�������úϳ������ǵĻ�ѧ����ʽΪ_____��
��5���������к��е��۵ķ���Ϊ_____��