题目内容
【题目】有一包固体物质X,由KOH、Na2SO4、CaCO3、BaCl2、Cu(NO3)2中的两种或两种以上混合而成.为探究其成分,某学习小组进行如下实验: 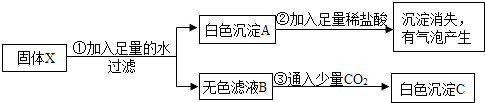
(1)从步骤①的实验结果推知,固体X中一定不存在 .
(2)步骤②发生反应的化学方程式为 , 此反应类型是 .
(3)从步骤③的实验结果推知,白色沉淀C为 .
(4)根据上述实验推断固体X由组成(填写化学式).
(5)假设去掉实验步骤③,仅从步骤①、②的实验结果推断,固体X的组成可能有种.
【答案】
(1)Cu(NO3)2
(2)CaCO3+2HCl=CaCl2+CO2↑+H2O;复分解反应
(3)BaCO3
(4)CaCO3、KOH、BaCl2
(5)5
【解析】解:硝酸铜在溶液中显蓝色,加入足量水得到白色沉淀A,其可能为不溶于水的碳酸钙或硫酸钠与氯化钡反应生成的硫酸钡,后加入足量稀盐酸,沉淀消失且有气泡产生,说明该白色沉淀为碳酸钙而不为硫酸钡,从而说明固体X中一定含有碳酸钙,只能含有硫酸钠或氯化钡中的一种,后由步骤3推导只含氯化钡而不含硫酸钠.(1)从步骤①的实验结果推知,固体X中一定不存在Cu(NO3)2;(2)通过推导可知,步骤②发生的反应是碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O,该反应满足复分解反应的条件,属于复分解反应;(3)通过分析步骤③的实验结果推知,氢氧化钾和二氧化碳反应会生成碳酸钾,碳酸钾和氯化钡会生成碳酸钡沉淀,所以白色沉淀C为:BaCO3;(4)通过推导可知,固体X由CaCO3、KOH、BaCl2组成;(5)去掉实验步骤③,仅从步骤①、②的实验结果推断,固体X的组成可能有:①CaCO3、BaCl2 , ②CaCO3 BaCl2 KOH,③CaCO3 Na2SO4 , ④CaCO3 Na2SO4 KOH,⑤CaCO3 KOH,所以组成可能有5种.所以答案是:(1)Cu(NO3)2;(2)CaCO3+2HCl=CaCl2+CO2↑+H2O,复分解反应;(3)BaCO3;(4)CaCO3、KOH、BaCl2;(5)5.
【考点精析】认真审题,首先需要了解书写化学方程式、文字表达式、电离方程式(注意:a、配平 b、条件 c、箭号).

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案