题目内容
【题目】MgSO47H2O是一种重要的化工原料,某工厂以一种镁矿石(主要成分为SiO2和MgCO3,还含有少量FeCO3)为原料制备MgSO47H2O的主要流程如下:
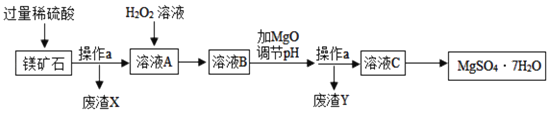
已知:SiO2既不溶于水也不溶于稀硫酸。请回答下列问题:
(1)溶液A中的溶质是_____(填化学式)。
(2)“溶液A”中加入H2O2溶液会生成Fe2(SO4)3,该反应的化学方程式为_____。在该反应中H2O2转化为H2O,则H2O2在该反应中属于_____(选填“还原剂”或“氧化剂”)
(3)选用MgO调节pH使Fe3+转化为沉淀,而不选用NaOH的原因是_____。
【答案】FeSO4、MgSO4、H2SO4 2FeSO4+H2SO4+H2O2=Fe2(SO4)3+2H2O 氧化剂 氢氧化钠和硫酸反应会生成新的杂质硫酸钠
【解析】
(1)碳酸镁和硫酸反应生成硫酸镁、水和二氧化碳,碳酸亚铁和硫酸反应生成硫酸亚铁、水和二氧化碳,所以溶液A中的溶质是:FeSO4、MgSO4和H2SO4;
(2)硫酸亚铁、硫酸和过氧化氢反应生成硫酸铁和水,化学方程式为:2FeSO4+H2SO4+H2O2=Fe2(SO4)3+2H2O,在该反应中H2O2转化为H2O,则H2O2在该反应中属于氧化剂;
(3)除杂的原则:除去杂质,不能引入新的杂质,所以选用MgO调节pH使Fe3+转化为沉淀,而不选用NaOH的原因是:氢氧化钠和硫酸反应会生成新的杂质硫酸钠。

 习题精选系列答案
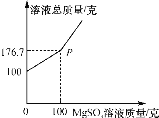
习题精选系列答案【题目】如图所示,在甲、乙、丙、丁四个盛有100g水的烧杯中,分别放入KNO3固体,充分溶解。下列关于甲、乙、丙、丁所得溶液的说法正确的是( )
温度℃ | t1 | t2 |
KNO3的溶解度(g/100g水) | 60 | 90 |
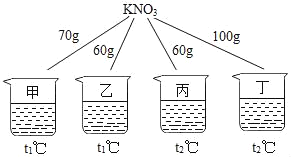
A. 溶液质量:乙=丙<甲<丁
B. 甲、乙、丙、丁均为饱和溶液
C. 将甲升温至t2℃,溶液质量增加
D. 将丁降温至t1℃,没有固体析出
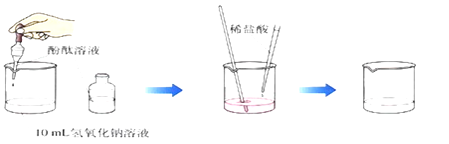
【题目】学校化学兴趣小组的同学们在学习了酸碱盐的性质后同老师到化学实验室中对酸碱盐进行了探究。
【实验探究一】 酸碱中和反应
实验小组在向氢氧化钠溶液中滴加稀盐酸进行中和反应操作时,忘记预先在氢氧化钠溶液中加入酚酞试液,为判断反应进行的程度,决定对反应后溶液的性质进行以下探究:
【猜想假设】猜想①盐酸不足量; 猜想②恰好完全中和; 猜想③盐酸过量
【方案设计】(并填写表中的空格)
实验方案 | 实验操作 | 实验现象 | 实验结论 |
方案一 | 取适量反应后的溶液于试管中,滴加几滴无色的酚酞试液,振荡 | 溶液变红色 | 猜想①正确 |
方案二 | 用一根洁净的玻璃棒蘸取反应后的溶液滴在pH试纸上,把试纸呈现的颜色与标准比色卡对照 | pH=7 | ______ |
方案三 | 取适量锌粒于试管中,加入适量反应后的溶液 | _______ | 猜想③正确 |
【评价反思】甲同学按方案一进行实验,观察到溶液未变色,则甲同学可以得出的结论是__________(填字母序号)
A、猜想②正确 B、猜想③正确 C、猜想②或③正确
【实验探究二】 探究盐的性质
盐的代表是碳酸钠(Na2CO3),它是食用碱的主要成分(常含有少量的NaCl)。兴趣小组的同学为测定市售食用碱中Na2CO3的含量,设计了如图实验装置:

设计思路:用空气将装置B中生成的二氧化碳缓缓吹入装置D中,利用装置D的质量变化测定食用碱中Na2CO3的含量。请结合实验装置和设计思路,回答下面问题:
①装置D中发生反应的化学方程式为___________________________________;
②装置A的作用是____________,装置E的作用是_______________;
③缓缓通入空气的目的是_________________。
④若撤除装置A,直接通入空气会导致实验结果_______(填“偏大”、“偏小”或“不变”),若撤除装置C,对实验结果的影响是_______(填“偏大”、“偏小”或“不变”)。