题目内容
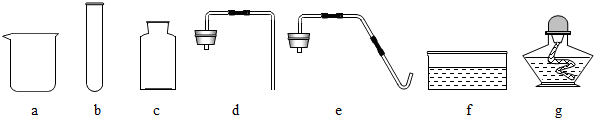
根据下列制取氧气的装置图回答问题: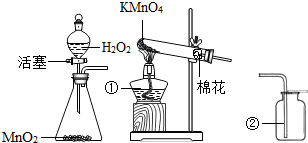
(1)写出仪器①,②的名称①
(2)实验室常用高锰酸钾或用过氧化氢和二氧化锰来制取氧气,你认为其中相对较好的方法是
(3)要得到较纯的氧气,用
(4)写出上图中发生反应的两个化学反应式①
(5)何洁同学在制取氧气过程中,她收集一瓶氧气后,用带火星的木条伸入瓶口、瓶中、瓶底,都未见木条复燃.其原因可能是
(6)工业上制氧气与实验室制氧气在原理上有什么本质区别?
分析:(1)熟悉常见仪器的名称和用途;
(2)分析比较实验室用高锰酸钾和用过氧化氢和二氧化锰来制取氧气的优缺点;
(3)分析收集较纯净氧气的方法,如何收集最好;
(4)书写用过氧化氢和二氧化锰或用高锰酸钾来制取氧气的化学方程式;
(5)分析实验中常出现的一种现象,收集的氧气不能使带火星的木条复燃;
(6)分析工业上制氧气与实验室制氧气在原理上的本质区别.
(2)分析比较实验室用高锰酸钾和用过氧化氢和二氧化锰来制取氧气的优缺点;
(3)分析收集较纯净氧气的方法,如何收集最好;
(4)书写用过氧化氢和二氧化锰或用高锰酸钾来制取氧气的化学方程式;
(5)分析实验中常出现的一种现象,收集的氧气不能使带火星的木条复燃;
(6)分析工业上制氧气与实验室制氧气在原理上的本质区别.
解答:解:(1)读图可知仪器①是酒精灯,②是集气瓶;
(2)实验室用高锰酸钾和用过氧化氢和二氧化锰来制取氧气,其中用过氧化氢和二氧化锰制取氧气优点更多.即不需加热;可以控制反应速率;生成物对环境没有污染(任答一条即可);
(3)要得到较纯的氧气,用排水法收集更好,在当水槽中的导管口处气泡连续均匀放出时开始收集.
(4)用过氧化氢和二氧化锰或用高锰酸钾来制取氧气的化学方程式为:2H2O2
2H2O+O2↑,
2KMnO4
K2MnO4+MnO2+O2↑.都属于分解反应.
(5)收集的氧气,用带火星的木条伸入瓶口、瓶中、瓶底,木条都不能复燃,可能的原因有:装置气密性不好;用错药品或药品变质;收集的时间不够长(任答一条即可,其他合理答案均可).
(6)工业上制氧气与实验室制氧气在原理上的本质区别是:工业制氧气是物理变化而实验室制氧气是化学娈化.
故答案为:
(1)①酒精灯②集气瓶;
(2)用过氧化氢和二氧化锰制取氧气;不需加热;可以控制反应速率;生成物对环境没有污染(任答一条即可);
(3)排水法,气泡连续均匀放出;
(4)2H2O2
2H2O+O2↑,2KMnO4
K2MnO4+MnO2+O2↑,分解反应;
(5)装置气密性不好;用错药品或药品变质;收集时间不够长(其他合理答案均可);
(6)工业制氧气是物理变化而实验室制氧气是化学娈化.
(2)实验室用高锰酸钾和用过氧化氢和二氧化锰来制取氧气,其中用过氧化氢和二氧化锰制取氧气优点更多.即不需加热;可以控制反应速率;生成物对环境没有污染(任答一条即可);
(3)要得到较纯的氧气,用排水法收集更好,在当水槽中的导管口处气泡连续均匀放出时开始收集.
(4)用过氧化氢和二氧化锰或用高锰酸钾来制取氧气的化学方程式为:2H2O2
| ||
2KMnO4
| ||
(5)收集的氧气,用带火星的木条伸入瓶口、瓶中、瓶底,木条都不能复燃,可能的原因有:装置气密性不好;用错药品或药品变质;收集的时间不够长(任答一条即可,其他合理答案均可).
(6)工业上制氧气与实验室制氧气在原理上的本质区别是:工业制氧气是物理变化而实验室制氧气是化学娈化.
故答案为:
(1)①酒精灯②集气瓶;
(2)用过氧化氢和二氧化锰制取氧气;不需加热;可以控制反应速率;生成物对环境没有污染(任答一条即可);
(3)排水法,气泡连续均匀放出;
(4)2H2O2
| ||
| ||
(5)装置气密性不好;用错药品或药品变质;收集时间不够长(其他合理答案均可);
(6)工业制氧气是物理变化而实验室制氧气是化学娈化.
点评:该题从多种方法制取氧气的优缺点比较,以及实验中可能出现的问题分析等方面命题,立意新颖,层次高.

练习册系列答案
相关题目
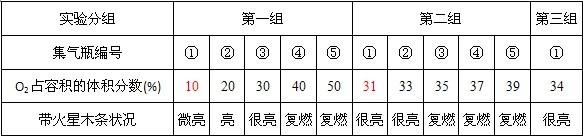
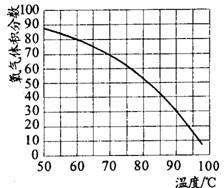
 过碳酸钠固体是过氧化氢和碳酸钠加合而成的化合物.其化学式为2Na2CO3?3H2O2,有关该化合物叙述如下.
过碳酸钠固体是过氧化氢和碳酸钠加合而成的化合物.其化学式为2Na2CO3?3H2O2,有关该化合物叙述如下.