题目内容
(2012?崇川区一模)工业上以黄铁矿(主要成分FeS2,杂质不含硫元素)为原料生产硫酸.其反应原理为:
①FeS2与O2高温下反应生成SO2;
②SO2在催化剂作用下与O2反应生成SO3;
③SO3与H2O反应生成H2SO4.
试回答以下问题:
(1)生产中的尾气未经处理,排放到空气中会引起的环境问题是
(2)FeS2中硫元素的质量分数为
(3)若1.00t SO2与O2的混合气体中,含SO2 0.40t.在一定条件下反应,有80%的SO2发生转化,则反应后SO3的质量是
(4)若上述SO3与H2O完全反应,可生产98%浓硫酸多少吨?(计算过程写在答题卡上)
①FeS2与O2高温下反应生成SO2;
②SO2在催化剂作用下与O2反应生成SO3;
③SO3与H2O反应生成H2SO4.
试回答以下问题:
(1)生产中的尾气未经处理,排放到空气中会引起的环境问题是
引起酸雨
引起酸雨
.(2)FeS2中硫元素的质量分数为
53.33%
53.33%
.(3)若1.00t SO2与O2的混合气体中,含SO2 0.40t.在一定条件下反应,有80%的SO2发生转化,则反应后SO3的质量是
0.4t
0.4t
,反应后混合气体中SO3的质量分数是40%
40%
.(4)若上述SO3与H2O完全反应,可生产98%浓硫酸多少吨?(计算过程写在答题卡上)
分析:二氧化硫是造成酸雨的主要气体,FeS2中硫元素的质量分数,可以根据化学式计算;根据化学方程式的计算求三氧化硫的质量和参加反应的氧气的质量,再求反应后混合气体中SO3的质量分数;根据化学方程式的计算要准确.
解答:解:(1)二氧化硫是造成酸雨的主要气体,故答案为:引起酸雨
(2)FeS2中硫元素的质量分数=故答案为:53.33%
(3)在一定条件下反应,有80%的SO2发生转化,因此参加反应的二氧化硫是:0.40t×80%=0.32t,根据化学方程式的计算求得三氧化硫的质量;
设生成三氧化硫的质量为x,
2SO2 +O2 =2SO3
2×64 2×80
0.32t x
=
x=0.4t
参加反应的氧气的质量=0.4t-0.32t=0.08t,剩余氧气=0.6t-0.08t=0.52t
反应后混合气体中SO3的质量分数=
×100%=40%
故答案为:0.4t; 40%
(4)设可生产98%的浓硫酸的质量为x
SO3+H2O=H2SO4
80 98
0.4 t 100x×98%
x=
=0.5 t
答:可生产98%的浓硫酸的质量0.5 t.
故答案为:0.5 t
(2)FeS2中硫元素的质量分数=故答案为:53.33%
(3)在一定条件下反应,有80%的SO2发生转化,因此参加反应的二氧化硫是:0.40t×80%=0.32t,根据化学方程式的计算求得三氧化硫的质量;
设生成三氧化硫的质量为x,
2SO2 +O2 =2SO3
2×64 2×80
0.32t x
| 2×64 |
| 0.32t |
| 2×80 |
| x |
参加反应的氧气的质量=0.4t-0.32t=0.08t,剩余氧气=0.6t-0.08t=0.52t
反应后混合气体中SO3的质量分数=
| 0.4t |
| 0.08t+0.4t+0.52t |
故答案为:0.4t; 40%
(4)设可生产98%的浓硫酸的质量为x
SO3+H2O=H2SO4
80 98
0.4 t 100x×98%
x=
| 0.4t×98 |
| 80×98% |
=0.5 t
答:可生产98%的浓硫酸的质量0.5 t.
故答案为:0.5 t
点评:本考点考查了物质的制备,物质的制备有一下几种类型:一种是只能用题目给出的原料来制取;一种是自己选取原料来制备新物质;还有的是给你一部分药品,其它自选等.要结合物质的性质,灵活应用,答案就会迎刃而解.

练习册系列答案
相关题目
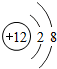 ⑥
⑥ ⑦
⑦