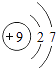题目内容
【题目】某兴趣小组对物质的性质和成分进行相关探究.
(1)常见金属活动性顺序如下,填写相应的元素符号: ![]()
某同学用硫酸铜溶液把“把铁刀变成铜刀”,其反应的化学方程式为 , 该反应的基本反应类型为 .
(2)兴趣小组同学用氧化铜与足量的炭粉利用图甲所示装置进行实验,对生成气体的成分进行探究. 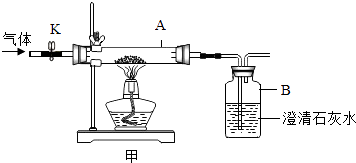 【提出问题】生成的气体中是否含有一氧化碳?
【提出问题】生成的气体中是否含有一氧化碳?
【实验与讨论】
①打开K,缓缓通入干燥的氮气一段时间.
②关闭K,加热至一定温度使之反应,用气囊收集气体样品.
③除去气体样品中的二氧化碳,并将剩余气体收集在集气瓶中,下列装置中最为合理的是 . 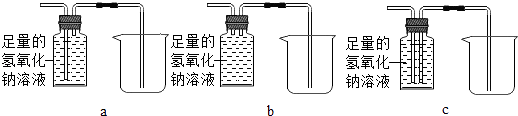
(3)【实验求证】 将除尽二氧化碳后的气体样品干燥,仍然用图甲所示的装置进行实验,A中的固体应选用 , B中溶液为澄清石灰水,若A中黑色固体出现了红色,B中澄清石灰水 , 可说明气体样品中含有一氧化碳.
【实验反思】
炭粉还原氧化铜的实验中,若生成的气体中含有一氧化碳,则反应时消耗碳、氧元素的质量比(填“大于”、“等于”或“小于”)3:8.
【答案】
(1)Fe+CuSO4═Cu+FeSO4;置换反应
(2)c
(3)氧化铜;变浑浊;大于
【解析】解:(1)由金属的活动性顺序为K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au可知,在金属活动顺序表空格内应填入Mg、Ag;铁与硫酸铜溶液反应生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4=Cu+FeSO4;该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应;(2)【实验与讨论】除去气体样品中的二氧化碳,应将气体通入到氢氧化钠溶液中,由于一氧化碳的密度小于水的密度,可通过右边长导管将氢氧化钠排出,将气体收集在集气瓶中,所以,最为合理装置是c; 【实验求证】为了验证生成的气体中是否含有一氧化碳,A中应加入的固体是氧化铜,实验的现象是B中澄清石灰水浑浊,可说明气体样品中含有一氧化碳等.
【实验反思】由于在一氧化碳、二氧化碳中,碳、氧元素的质量比分别是3:4、3:8,所以,炭粉还原氧化铜的实验中,若生成的气体中含有一氧化碳,则反应时消耗碳、氧元素的质量比大于3:8.
所以答案是:(1)Mg、Ag,Fe+CuSO4=Cu+FeSO4 , 置换反应;(2)【实验与讨论】c;【实验求证】氧化铜、变浑浊;【实验反思】大于.
【考点精析】解答此题的关键在于理解金属活动性顺序及其应用的相关知识,掌握在金属活动性顺序里:1、金属的位置越靠前,它的活动性就越强2、位于氢前面的金属能置换出盐酸、稀硫酸中的氢(不可用浓硫酸、硝酸)3、位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来.(除K、Ca、Na),以及对书写化学方程式、文字表达式、电离方程式的理解,了解注意:a、配平 b、条件 c、箭号.

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案