题目内容
【题目】科学实验小组用 10克锌和足量的稀硫酸反应制取氢气,并用氢气还原氧化铜制取铜,装置如图甲所示。同学们通过计算:理论上要制取 6.4g铜,需要消耗氧化铜 8g,锌 6.5 克。科学实验小组按照规范操作要求完成上述实验,将 8g氧化铜完全反应得到 6.4g 铜。根据实际反应情况,以加入的 Zn的质量为横坐标,以生成的Cu的质量为纵坐标,画出对应的质量关系如图乙所示。
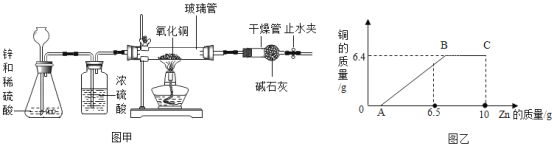
(1)如何检查该实验装置的气密性:_____(简述操作、现象、结论)
(2)分析图乙各段的理由_____。
【答案】夹上止水夹,从长颈漏斗加水,一直到漏斗内有明显液柱位置,观察液柱是否稳定存在且液面保持不下降,如果不下降则气密性良好,反之则气密性不好 OA段是生成氢气,此时氢气的作用是排空装置内的空气或者氧气,防止发生爆炸。AB段是加热氧化铜,此时氧化铜和氢气反应生成铜和水。BC段是继续通入氢气,此时氢气的作用是作保护气,防止铜被氧化
【解析】
(1)由于装置气密性检查需要首先构建密闭体系,所以夹上止水夹,从长颈漏斗加水,一直到漏斗内有明显液柱位置,观察液柱是否稳定存在且液面保持不下降,如果不下降则气密性良好,反之则气密性不好。
(2)由于氢气还原氧化铜,是先通入氢气排空装置内的氧气防止发生爆炸,氧化铜完全反应后继续通入氢气保护生成的铜,从而防止铜被氧化,所以OA段是先生成氢气,此时氢气的作用是排空装置内的空气或者氧气,防止发生爆炸。AB段是加热氧化铜,此时氧化铜和氢气反应生成铜和水。BC段是继续通入氢气,此时氢气的作用是作保护气,防止铜被氧化。

练习册系列答案
相关题目