题目内容
“用双氧水和二氧化锰制氧气”的实验,某同学做了该实验后,展开了下列思考与探究:(1)催化剂MnO2的用量对反应速率有没有影响呢?他做了这样一组实验:每次均用30mL10%的H202溶液,采用不同量MnO2粉末做催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他实验条件均相同)
请分析表中数据回答:MnO2的用量对反应速率有没有影响呢?如果有,是怎样影响的呢?
答:________________________________________________。
(2)H2O2溶液的溶质质量分数对反应速率有没有影响呢?他又做了一组实验:每次均取5mL30%的H2O2溶液,然后稀释成不同溶质质量分数的溶液进行实验,每次所用二氧化锰的质量均为0.2克。记录数据如下:(实验均在20℃室温下进行,其他实验条件也均相同)
请分析表中数据回答:H2O2溶液的溶质质量分数对反应速率有没有影响呢?如果有,是怎样影响的呢?
答:____________________________________。
由表中数据还可看出,该反应是个__________(填“放热”或“吸热”) 反应。
(3)还有哪些因素可能影响该反应的速率呢?
请说出你的一个猜想:__________________________。
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| MnO2粉末用量(克) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
| 所用时间(秒) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 | 2 | 2 |
答:________________________________________________。
(2)H2O2溶液的溶质质量分数对反应速率有没有影响呢?他又做了一组实验:每次均取5mL30%的H2O2溶液,然后稀释成不同溶质质量分数的溶液进行实验,每次所用二氧化锰的质量均为0.2克。记录数据如下:(实验均在20℃室温下进行,其他实验条件也均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| H2O2溶液溶质质量分数 | 1% | 3% | 5% | 10% | 15% | 20% | 25% | 30% |
| 收集到540mL气体时所用时间(秒) | 660 | 220 | 205 | 80 | 25 | 9 | 4 | 3 |
| 反应后液体温度(℃) | 24 | 34 | 39 | 56 | 65 | 67 | 69 | 70 |
答:____________________________________。
由表中数据还可看出,该反应是个__________(填“放热”或“吸热”) 反应。
(3)还有哪些因素可能影响该反应的速率呢?
请说出你的一个猜想:__________________________。
(1)答:小于0.7g时,MnO2的用量越大,反应速率越快。当大于0.7g时,无影响。(2)有,质量分数越大,反应速率越大,放热(3)环境温度对反应速率有没有影响呢?
:(1)从表中可以看出,采用了H2O2相同浓度和相同量,随着MnO2增加,收集到相同体积的O2所用时间也减少,说明反应速度在加快;但是当MnO2达到0.7g后所用时间就相同了,所以在一定范围内增加MnO2加快反应速度.
(2)从表中可以看出,随着H2O2溶液的质量分数提高,MnO2加入的量相同,收集到相同体积的O2所用时间也在减少,反应的速度在增加.同样温度开始反应,反应后温度比反应前提高,这说明是放热反应.
(3)根据对反应速度影响的因素中还有气压、温度、反应物颗粒大小等.
(2)从表中可以看出,随着H2O2溶液的质量分数提高,MnO2加入的量相同,收集到相同体积的O2所用时间也在减少,反应的速度在增加.同样温度开始反应,反应后温度比反应前提高,这说明是放热反应.
(3)根据对反应速度影响的因素中还有气压、温度、反应物颗粒大小等.

练习册系列答案
相关题目



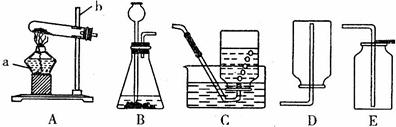
 (2)用高锰酸钾来制取氧气时,可选用的发生装置是 (填序号),还缺少的是 ; 用排水法收集氧气实验完毕后应先 ,后 。其目的是 。
(2)用高锰酸钾来制取氧气时,可选用的发生装置是 (填序号),还缺少的是 ; 用排水法收集氧气实验完毕后应先 ,后 。其目的是 。