题目内容
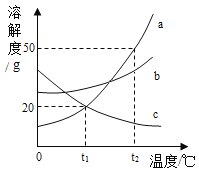
【题目】向盛有Fe2O3粉末的烧杯中加入过量的稀H2SO4,充分搅拌,粉末完全溶解;再向所得溶液中逐滴加入NaOH溶液,生成沉淀与加入NaOH溶液之间的质量关系如图所示。请回答下列问题:

(1)写出AB段内反应的化学方程式:_____。
(2)加入NaOH溶液40 g时溶液中存在的溶质是______(写化学式)。
(3)计算氢氧化钠溶液中溶质的质量分数。_____(要求写出计算过程)
【答案】2NaOH+H2SO4=Na2SO4+2H2O Na2SO4、Fe2(SO4)3 15%
【解析】
根据生成的氢氧化铁的质量和对应的化学方程式求算氢氧化钠的质量,进而求算对应的质量分数。
(1)硫酸铁和硫酸的混合物中加入氢氧化钠,氢氧化钠先与硫酸反应,硫酸反应完全后,氢氧化钠与硫酸铁反应,所以AB段内反应的化学方程式:2NaOH+H2SO4=Na2SO4+2H2O;故填:2NaOH+H2SO4=Na2SO4+2H2O
(2)加入NaOH溶液40g时,此时硫酸恰好完全反应,而硫酸铁没有开始反应,溶液中存在的溶质是生成的硫酸钠和尚未反应的硫酸铁,对应的化学式为Na2SO4、Fe2(SO4)3。故填:Na2SO4、Fe2(SO4)3
(3)设与Fe2(SO4)3反应的NaOH的质量为x。

![]()
![]()
NaOH溶液的溶质质量分数为![]() ;故填:15%
;故填:15%

练习册系列答案
相关题目