题目内容
日常生活中的食醋是醋酸的稀溶液,如果在食醋中醋酸所含的氢原子与水中所含的氢原子个数比为1:40,则该食醋中醋酸的质量分数为( )
| A、1% | B、4% | C、8% | D、10% |
分析:由醋酸的化学式CH3COOH,水的化学式H2O,所以每个醋酸的分子与水分子中氢原子的个数比是2:1,可以看出当醋酸所含的氢原子与水中所含的氢原子个数比为1:40时,因此此溶液中醋酸分子与水分子的个数比应为1:80,利用相对分子质量并结合溶质质量分数的计算可解决此题.
解答:解:有两物质的化学式可知:当醋酸所含的氢原子与水中所含的氢原子个数比为1:40时,两分子的个数比应为1:80,则醋酸的溶质质量分数为:
×100%=
×100%=4%
故选B
| 12×2+16×2+4 |
| (12×2+16×2+4)+80×(2+16) |
| 60 |
| 1500 |
故选B
点评:此题是对醋酸溶质质量分数的考查,利用的是溶液中两种分子的个数关系,结合相对分子质量及溶质的质量分数对要求进行求解是此题的解题方法.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
日常生活中的食醋是醋酸
(分子式为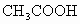 )的稀溶液,如果食醋中醋酸所含的H原子与水中所含的H原子个数比为1∶40,该食醋中醋酸的质量分数为
)的稀溶液,如果食醋中醋酸所含的H原子与水中所含的H原子个数比为1∶40,该食醋中醋酸的质量分数为
[
]|
A .1% |
B .4% |
|
C .8% |
D .10% |