题目内容
【题目】某化学兴趣小组欲为某化工厂测定大理石样品中碳酸钙的质量分数(杂质不与盐酸反应也不溶解)取12.5g样品加入到稀盐酸中,产生CO2的质量与稀盐酸的质量关系如图所示,请回答:
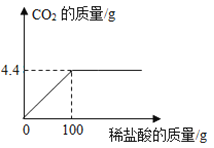
(1)该实验最多制得CO2的质量_______g。
(2)该碳酸钙样品中碳酸钙的质量分数__________。
(3)配制100g这种稀盐酸需要多少克质量分数为29.2%的盐酸__________?(写出计算过程)
【答案】4.4g 80% 25g
【解析】
(1)由图可以看出生成的二氧化碳的质量为4.4g;故填:4.4。
(2)设参加反应的碳酸钙的质量为x,HCl的质量为y;

x=10g,y=7.3g
则样品中碳酸钙的质量分数即纯度为![]() ×100%=80%;
×100%=80%;
答:该碳酸钙样品中碳酸钙的质量分数80%。
(3)所用盐酸中溶质的质量分数![]() ×100%=7.3%;
×100%=7.3%;
设配制100g质量分数为29.2%的盐酸的质量为z
则7.3%×100g=x×29.2%,解得z=25g;
故填:25g。

【题目】“暖贴”是我们冬天中常用的一种用品。某化学兴趣小组对暖贴中成分及发热原理展开了探究。
(1)“暖贴”中含有铁粉、活性炭、水、氯化钠等物质,其发热原理就是利用铁生锈时会放热,其中一种生成物是Fe(OH)3,请写出化学方程式:_____________。
(2)检验配料中含有铁粉。用磁铁吸引黑色粉末,发现部分黑色粉末被吸引;取少量附着在磁铁上的粉末于试管中,加入适量稀盐酸,通过观察到的现象是产生气泡、_____________,得出配料中含有铁粉。
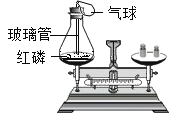
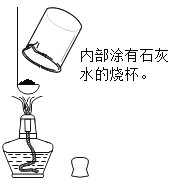
(3)检验配料中含有活性炭。暖贴中的活性炭是利用它能_____________大量潮湿的空气,为铁粉氧化提供条件。小明用图中所示方法实验,将暖贴放在燃烧匙中,在酒精灯上加热,观察到烧杯内壁变浑浊,说明含有活性炭。此方案___________(填可行”或“不可行”),若可行,写出其理论依据,若不可行,请写出合适的方法_____________。
(4)探究暖贴中活性炭、食盐、水等物质的作用实验数据如下:
实验编号 | 实验药品及用量 | 反应时间/min | 温度上升值/℃ | ||||
铁粉/g | 活性炭/g | 食盐/g | 水/g | ||||
对照组 | 2 | 0.4 | 0.2 | 8 | 10 | 60 | |
实验组 | 1 | 0 | 0.4 | 0.2 | 8 | 10 | 0 |
2 | 2 | 0.4 | 0 | 8 | 10 | 30 | |
3 | 2 | 0.4 | 0.2 | 0 | 10 | 6.5 | |
4 | 2 | a | b | 8 | 10 | 3.7 | |
①分析对照组与实验组第____________组的数据,能证明食盐能加快铁粉的锈蚀速率。
②实验组第4组数据中:a=___________,b=_______________。
(5)(反思与评价)下列说法正确的是________________。
A暖贴在使用前要密封保存
B暖贴使用后剩余物可以回收利用
C利用铁生锈的原理,铁粉还可用于食品保鲜