题目内容
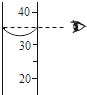
【题目】鸡蛋壳的主要成分是碳酸钙.某兴趣小组为了测定鸡蛋壳中CaCO3的含量,现取15g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入80g某浓度的稀盐酸,使之充分反应(鸡蛋壳中除CaCO3外的其他成分都不溶于水,且不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发),其中当反应进行到B点时,所有盐酸刚好消耗了加入量的一半.试计算(计算结果保留1位小数):

(1)产生CO2的质量为 g;
(2)所用稀盐酸中溶质的质量分数.
(3)鸡蛋壳中CaCO3的质量分数.
【答案】(1)生成二氧化碳的质量为4.4g;
(2)所用稀盐酸中溶质的质量分数为18.25%;
(3)鸡蛋壳中CaCO3的质量分数为:66.7%.
【解析】反应生成CO2的质量为95g﹣90.6g=4.4g,
设鸡蛋壳中含CaCO3的质量为x,反应消耗的HCl的质量为y,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 44
x y 4.4g
![]() =
=![]() =
=![]()
x=10g
y=7.3g
因为盐酸刚好消耗了加入量的一半
所以80g稀盐酸中溶质质量=7.3g×2=14.6g
盐酸溶液中溶质的质量分数为:![]() ×100%=18.25%;
×100%=18.25%;
鸡蛋壳中CaCO3的质量分数为:![]() ×100%≈66.7%.
×100%≈66.7%.
故答案为:(1)生成二氧化碳的质量为4.4g;
(2)所用稀盐酸中溶质的质量分数为18.25%;
(3)鸡蛋壳中CaCO3的质量分数为:66.7%.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目