题目内容
【题目】现有20g赤铁矿样品,为测定其中氧化铁的量,将样品放入烧杯中,并向烧杯中不断加入稀盐酸(样品中杂质不溶于水,也不和酸反应,测得烧杯中的固体质量随加入的稀盐酸质量的变化趋势如图所示.请计算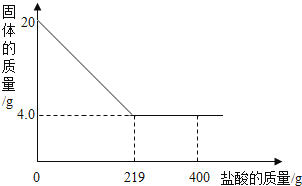
(1)该赤铁矿样品中,氧化铁的质量为 .
(2)所用稀盐酸溶质的质量分数.
【答案】
(1)16g
(2)
解:设所用219g稀盐酸中HCl的质量为x
Fe2O3+6HCl=2FeCl3+3H2O
160 219
16g x
![]()
x=21.9g
稀盐酸的溶质质量分数= ![]() 100%=10%.
100%=10%.
答:所用稀盐酸溶质的质量分数为10%.
【解析】(1)固体剩余的质量是杂质的质量为4g,由杂质的质量可计算出赤铁矿石中氧化铁的质量为20g﹣4g=16g;
(1)固体剩余的质量是杂质的质量,由杂质的质量可计算出赤铁矿石中氧化铁的质量解答;(2)由氧化铁和稀盐酸恰好完全反应,由氧化铁的质量可以根据化学方程式计算出消耗氯化氢的质量,进而计算出稀盐酸的溶质质量分数.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目