题目内容
【题目】(6分)某化学兴趣小组进行研究性学习,探究热水壶中的水垢。
【查阅资料】①天然水中一般都含有Ca2+、Mg2+、HCO3-等离子,在加热时,这些离子反应生成溶解度更小的物质—水垢[Mg(OH)2和CaCO3]。②碱石灰是氧化钙和氢氧化钠的固体混合物。
【实验设计】
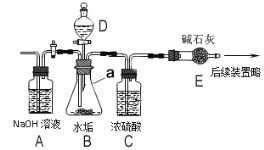
1、按图组装仪器,将10.8g水垢样品放入装置B中,在装置D中加入一定量的稀盐酸溶液;
2、将稀盐酸溶液缓缓滴入装置B中,与水垢充分反应;
3、待实验不再产生气泡时,打开AB间活塞,从左端缓缓鼓入一定量的空气;
4、吹扫一段时间后,测定到装置E质量增重了2.2g。
【分析数据】
(1)仪器a的名称是___________;
(2)鼓入空气的目的是__________;装置A的作用是_______;装置C中体现浓硫酸的__________性;
(3)写出实验中产生气体的化学反应方程式:_______________________;
(4)水垢中Mg(OH)2的质量为__________。
【答案】(1)锥形瓶
(2)使产生的气体向右流动与装置C、E充分接触;吸收空气中的CO2 ; 吸水。
(3)CaCO3+2HCl=CaCl2+H2O+CO2↑;(4)5.8g
【解析】
试题分析:(1)仪器a的名称是形瓶,(2)鼓入空气的目的是驱赶残留在装置中的气体,使之与装置C、E充分接触;装置A的作用是吸收空气中的CO2,防止干扰实验 ;装置C中体现浓硫酸的吸水性。(3)实验中产生气体的化学反应方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;(4)m(CO2)= 2.2g,则m(CaCO3)= 5.0g实验水垢中Mg(OH)2的质量为10.8g-5.0g=5.8g。

练习册系列答案
相关题目