题目内容
“低碳城市”的理念贯穿在上海世博园的建设中。
(1)“低碳城市”的建设减少了二氧化碳气体的排放,能减缓 的程度;自然界中消耗二氧化碳的主要途径是 ;请你写出一种日常生活中符合“低碳经济”理念的做法: 。
(2)法国化学家PaulSabatier采用“组合转化”技术使CO2和H2在催化剂作用下生成CH4和H2O。试写出该反应的化学方程式 。
(3)近来有科学家提出利用“碳捕捉技术”来降低工业生产中二氧化碳的排放量。“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存和利用。常利用足量的NaOH溶液来“捕捉”CO2,过程如下图所示(部分条件及物质未标出)。
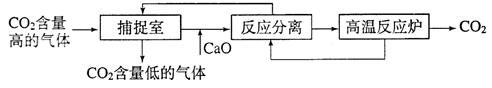
①捕捉室中发生反应的化学方程式为: 。
②把CaO放入反应分离室中与H2O反应,请写出该反应的化学方程式: ;利用此反应,氧化钙可用作食品 剂。
③“反应分离”中,得到固体物质的基本操作是 ,该固体是碳酸钙。
④整个过程中,可以循环利用的物质有 。
(4)取10g碳酸钙固体高温加热,一段时间后停止加热,测得剩余固体中钙元素的质量分数为50%,则下列判断正确的是
(1)“低碳城市”的建设减少了二氧化碳气体的排放,能减缓 的程度;自然界中消耗二氧化碳的主要途径是 ;请你写出一种日常生活中符合“低碳经济”理念的做法: 。
(2)法国化学家PaulSabatier采用“组合转化”技术使CO2和H2在催化剂作用下生成CH4和H2O。试写出该反应的化学方程式 。
(3)近来有科学家提出利用“碳捕捉技术”来降低工业生产中二氧化碳的排放量。“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存和利用。常利用足量的NaOH溶液来“捕捉”CO2,过程如下图所示(部分条件及物质未标出)。

①捕捉室中发生反应的化学方程式为: 。
②把CaO放入反应分离室中与H2O反应,请写出该反应的化学方程式: ;利用此反应,氧化钙可用作食品 剂。
③“反应分离”中,得到固体物质的基本操作是 ,该固体是碳酸钙。
④整个过程中,可以循环利用的物质有 。
(4)取10g碳酸钙固体高温加热,一段时间后停止加热,测得剩余固体中钙元素的质量分数为50%,则下列判断正确的是
| A.生成了2g二氧化碳 |
| B.剩余固体质量为5g |
| C.生成了5.6g氧化钙 |
| D.剩余碳酸钙的质量为8g |
(1)温室效应 光合作用 随手关灯,废物利用(合理即可)?
(2)CO2+4H2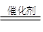 CH4+2H2O?
CH4+2H2O?
(3)①CO2+2NaOH ===Na2CO3+H2O?②CaO+H2O ===Ca(OH) 2 干燥?
③过滤?④CaO、NaOH? (4)A
(2)CO2+4H2
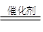 CH4+2H2O?
CH4+2H2O?(3)①CO2+2NaOH ===Na2CO3+H2O?②CaO+H2O ===Ca(OH) 2 干燥?
③过滤?④CaO、NaOH? (4)A
(1)二氧化碳是温室气体,可以引起温室效应;主要消耗二氧化碳气体是植物的光合作用;日常生活中符合“低碳经济”理念的做法如:节约用水、随手关灯、废物利用、少开私家车、多做公共汽车等。
(2)由题干所给信息可知,CO2和H2在催化剂作用下生成CH4和H2O,反应表达式为CO2+4H2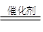 CH4+2H2O?。
CH4+2H2O?。
(3)①捕捉室是利用NaOH与CO2反应来“捕捉”CO2气体,CO2+2NaOH ===Na2CO3+H2O。
②CaO与水反应的方程式CaO+H2O ===Ca(OH) 2,可利于氧化钙与水反应,可将氧化钙作食品的干燥剂使用。
③“反应分离”中,是将不溶性固体与液体分离,故使用的基本操作是过滤。
④由图示可以看出,可以循环使用的是CaO、NaOH。
(4)根据质量守恒定律可知,反应前后元素的质量不变,反应前钙元素的质量=10g×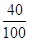 =4g
=4g
故反应后剩余固体质量为4g÷50%=8g,由化学方程式CaCO3 CaO+CO2↑可知固体减少的质量为气体二氧化碳的质量(10g-8g)=2g。生成CaO的质量为2g/44×56≠5.6g,故只有A正确。
CaO+CO2↑可知固体减少的质量为气体二氧化碳的质量(10g-8g)=2g。生成CaO的质量为2g/44×56≠5.6g,故只有A正确。
(2)由题干所给信息可知,CO2和H2在催化剂作用下生成CH4和H2O,反应表达式为CO2+4H2
 CH4+2H2O?。
CH4+2H2O?。(3)①捕捉室是利用NaOH与CO2反应来“捕捉”CO2气体,CO2+2NaOH ===Na2CO3+H2O。
②CaO与水反应的方程式CaO+H2O ===Ca(OH) 2,可利于氧化钙与水反应,可将氧化钙作食品的干燥剂使用。
③“反应分离”中,是将不溶性固体与液体分离,故使用的基本操作是过滤。
④由图示可以看出,可以循环使用的是CaO、NaOH。
(4)根据质量守恒定律可知,反应前后元素的质量不变,反应前钙元素的质量=10g×
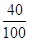 =4g
=4g故反应后剩余固体质量为4g÷50%=8g,由化学方程式CaCO3
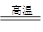 CaO+CO2↑可知固体减少的质量为气体二氧化碳的质量(10g-8g)=2g。生成CaO的质量为2g/44×56≠5.6g,故只有A正确。
CaO+CO2↑可知固体减少的质量为气体二氧化碳的质量(10g-8g)=2g。生成CaO的质量为2g/44×56≠5.6g,故只有A正确。
练习册系列答案
相关题目