题目内容
在一个密闭容器内有氧气、二氧化碳、水蒸汽和未知纯净物W,在一定条件下充分反应,测得反应前后各物质的质量如下:
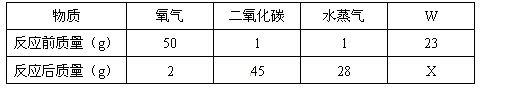
根据质量守恒定律,X的值是 g ;反应后的生成物是 ;
物质W中含 元素。

根据质量守恒定律,X的值是 g ;反应后的生成物是 ;
物质W中含 元素。
0; 二氧化碳和水; 碳、氢、氧
(答对2个得1分,答对1个不得分)
(答对2个得1分,答对1个不得分)
氧气反应后少了48g说明反应了48g,二氧化碳多了44g说明生成了44g二氧化碳,水蒸气多了27g说明生成了27g水,根据质量守恒定律,M属于反应物,并且反应了44+27-48=23g,所以X值为0;
算出二氧化碳中碳元素的质量为12g,水中氢元素的质量为3g,又因为二氧化碳中碳元素的质量、水中氢元素的质量都是由M中出来的,而12g+3g=15g,所以M中有氧元素.
由以上计算,设碳、氢原子个数比为x:y,则12x:1y=12:3,则x:y=1:3。
点评:根据图表先判断出反应物是谁,生成物是谁,分别反应了多少?生成了多少?再根据质量守恒定律进行推算.
算出二氧化碳中碳元素的质量为12g,水中氢元素的质量为3g,又因为二氧化碳中碳元素的质量、水中氢元素的质量都是由M中出来的,而12g+3g=15g,所以M中有氧元素.
由以上计算,设碳、氢原子个数比为x:y,则12x:1y=12:3,则x:y=1:3。
点评:根据图表先判断出反应物是谁,生成物是谁,分别反应了多少?生成了多少?再根据质量守恒定律进行推算.

练习册系列答案
相关题目
 ”分别表示两种不同元素的原子。依据下列信息,有关说法错误的是 【 】
”分别表示两种不同元素的原子。依据下列信息,有关说法错误的是 【 】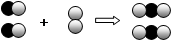
 )配制玻璃仪器的洗涤液,其中铬(Cr)元素的化合价为
)配制玻璃仪器的洗涤液,其中铬(Cr)元素的化合价为
