题目内容
(4分)石灰石的主要成分是碳酸钙(CaCO3),用含碳酸钙80%的石灰石200g与足量稀盐酸(HCl)反应(杂质不与稀盐酸反应),可制得纯度为80%的CO2气体多少克?
【答案】
88g。(方程式1分,算出或表示出碳酸钙质量1分,计算出二氧化碳质量1分,算出不纯的二氧化碳1分。)
【解析】根据碳酸钙的质量,利用化学方程式可求得生成二氧化碳的质量,进行解答
设反应生成的CO2质量为x
CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
100 44
200g×80% x
 x=70.4g
x=70.4g
纯度为80%的CO2气体=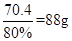

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目