题目内容
1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德?埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖.(1)用
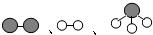 分别表示N2、H2、NH3.观察下图,写出符合在催化剂表面合成氨反应过程的顺序(将下面五张图按反应过程顺序用序号排列).
分别表示N2、H2、NH3.观察下图,写出符合在催化剂表面合成氨反应过程的顺序(将下面五张图按反应过程顺序用序号排列).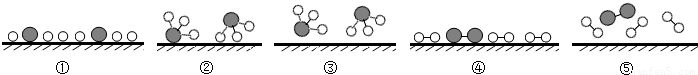
(2)氢气与氮气反应时的化学计量数比是;该反应属于反应.
0

练习册系列答案
相关题目
题目内容
1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德?埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖.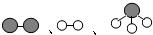 分别表示N2、H2、NH3.观察下图,写出符合在催化剂表面合成氨反应过程的顺序(将下面五张图按反应过程顺序用序号排列).
分别表示N2、H2、NH3.观察下图,写出符合在催化剂表面合成氨反应过程的顺序(将下面五张图按反应过程顺序用序号排列).
