题目内容
中和一定质量和一定质量分数的稀硫酸,需用mg氢氧化钠,若改用mg的氢氧化钾时,反应后溶液的pH应当是( )A.pH>7
B.pH=7
C.pH<7
D.无法确定
【答案】分析:根据氢氧化钠、氢氧化钾分别与硫酸反应的化学方程式,可判断等质量的氢氧化钠所消耗硫酸的质量大于氢氧化钾,因此与mg氢氧化钠恰好完全反应的硫酸在与mg氢氧化钾反应时会有剩余,即所得溶液呈酸性,pH小于7.
解答:解:根据反应的化学方程式,mg氢氧化钠中和硫酸的质量
2NaOH+H2SO4═Na2SO4+2H2O
80 98
mg g
g
mg氢氧化钾中和硫酸的质量
2KOH+H2SO4═K2SO4+2H2O
112 98
m g
g
由于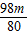 g>
g>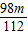 g,因此,用mg氢氧化钠中和一定质量和一定质量分数的稀硫酸,若改用mg的氢氧化钾时,硫酸会有剩余而使反应后溶液pH<7;
g,因此,用mg氢氧化钠中和一定质量和一定质量分数的稀硫酸,若改用mg的氢氧化钾时,硫酸会有剩余而使反应后溶液pH<7;
故选C.
点评:氢氧化钾与硫酸若恰好完全反应,反应后溶液呈中性,若硫酸有剩余则反应后溶液呈酸性,若氢氧化钾有剩余则反应后溶液呈碱性.
解答:解:根据反应的化学方程式,mg氢氧化钠中和硫酸的质量
2NaOH+H2SO4═Na2SO4+2H2O
80 98
mg
 g
gmg氢氧化钾中和硫酸的质量
2KOH+H2SO4═K2SO4+2H2O
112 98
m
 g
g由于
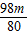 g>
g>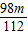 g,因此,用mg氢氧化钠中和一定质量和一定质量分数的稀硫酸,若改用mg的氢氧化钾时,硫酸会有剩余而使反应后溶液pH<7;
g,因此,用mg氢氧化钠中和一定质量和一定质量分数的稀硫酸,若改用mg的氢氧化钾时,硫酸会有剩余而使反应后溶液pH<7;故选C.
点评:氢氧化钾与硫酸若恰好完全反应,反应后溶液呈中性,若硫酸有剩余则反应后溶液呈酸性,若氢氧化钾有剩余则反应后溶液呈碱性.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目