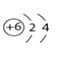题目内容
【题目】
(1)硫酸(H2SO4)中各元素的质量比是多少?
(2)将21g铁粉与足量的稀硫酸反应。计算:①生成的氢气和硫酸亚铁各多少克?②生成的氢气在标准状况下的体积是多少升?(氢气的密度是0.09g/L)
【答案】
(1)解:硫酸(H2SO4)中氢、硫、氧元素的质量比为:2:32:(16 ![]() )=1:16:32
)=1:16:32
(2)解:①设将21g铁粉与足量的稀硫酸反应生成硫酸亚铁的质量为x,生成氢气的质量为y
Fe+ H2SO4 = | FeSO4 + | H2↑ |
56 | 152 | 2 |
21g | x | y |
![]() =
= ![]() =
= ![]()
得x=57g ,y=0.75g,故生成氢气的质量为0.75g,生成硫酸亚铁的质量为57g;
②v= ![]() =
= ![]() =8.3L;故生成氢气的体积为8.3L
=8.3L;故生成氢气的体积为8.3L
【解析】(1)硫酸(H2SO4)中氢、硫、氧元素的质量比为:2:32:(16 × 4 )=1:16:32
(2)①设将21g铁粉与足量的稀硫酸反应生成硫酸亚铁的质量为x,生成氢气的质量为y
Fe+ H2SO4 = | FeSO4 + | H2↑ |
56 | 152 | 2 |
21g | x | y |
![]() =
= ![]() =
= ![]()
得x=57g ,y=0.75g,故生成氢气的质量为0.75g,生成硫酸亚铁的质量为57g;
②v= ![]() =
= ![]() =8.3L;故生成氢气的体积为8.3L
=8.3L;故生成氢气的体积为8.3L
答:(1)氢、硫、氧元素的质量比为:1:16:32。(2)生成氢气的质量为0.75g,生成硫酸亚铁的质量为57g;生成氢气的体积为8.3L
【考点精析】本题主要考查了根据化学反应方程式的计算的相关知识点,需要掌握各物质间质量比=系数×相对分子质量之比才能正确解答此题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目