��Ŀ����
ij��ѧ��ȤС����ʵ������̽��ijЩ�ᡢ���֮���Ƿ������ֽⷴӦ��
��ʵ����̽������д�±����ա�
���� |
|
|
��Һ����_____ |
���� | �����ݲ��� | ������_____�� | ��Һ�ɺ�ɫǡ�ñ����ɫ |
ʵ�� ���� | ��ѧ����ʽ�� _____�� | ��ѧ����ʽ�� H2SO4+Ba(NO3)2=BaSO4��+2HNO3 |
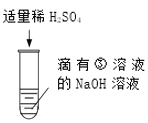
ͼ�С�?�������������� _____�������ӷ��ţ��� |
���� | �����������������_____����ˮ����ʱ�����ֽⷴӦ���Է����� |
����չ��Ӧ�ã���ʵ��һ����������Ӧ����ϲ���Һ����ͬһ�ྻ���ձ��У����������룩����ʵ�鼰������ͼ��

��1����ɫ��ҺB��pH_____7���<������>����=������
��2����ɫ����A��_____��
��3����ɫ��ҺB�г��˺��з�̪�⣬һ�������е�������_____��
��ѧ��Ӧ�������������ı仯���������Ƕ�ȥ��ʶ��ѧ�仯����ʶ��ѧ����Ҫ�ֶΡ�ʵ����Ʒ��37%��Ũ���ᣨ�ܶ�Ϊ1.18g/mL����10%������������Һ������ˮ��Ͳ���¶ȼơ�
ʵ��һ������100mL 10%�����ᣨ�ܶ�Ϊ1.05g/mL��
ʵ�鲽�裺
��1�����㣺��Ҫ37%��Ũ��������Ϊ______mL����ȷ��0.01mL����ͬ������Ҫ����ˮ�����Ϊ______mL��ˮ���ܶ�Ϊ10g/mL��
��2����ȡŨ���������ˮ
��3���������
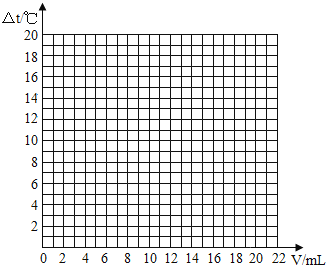
ʵ�������һ�������10%������������Һ�еμ�10%�����ᣨ�����£�����Ӧ����Һ�¶ȵı仯���£�
��������������V��mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
��Һ�¶ȱ仯����t���� | ��t1 | 5.2 | 9.6 | 12.0 | 16.0 | 18.2 | 16.7 | 15.7 | 14.7 | 13.7 | 12.9 |
�ٱ��С�t1��ֵΪ______��
��д���÷�Ӧ�Ļ�ѧ����ʽ______��
�۵�������������Ϊ10mLʱ��������Һ������һ������______��
�ܸ����ϱ���������������������0��10mL����Һ�¶ȱ仯�����Ƽ���ԭ����______��
�������������䣬������20%��������еμӣ���϶��������ߵķ�����������������ߵ��λ�ã���������Һ�ܶȺͱ����ݵı仯������ɢʧ��Ӱ�����أ�______