题目内容
写出硫在氧气中燃烧生成二氧化硫的化学方程式,求3.2g硫在足量的氧气中完全燃烧生成二氧化硫的质量?
答案:
解析:
提示:
解析:
|
【过程探究】硫在氧气中燃烧生成二氧化硫的化学方程式为: S+O2 根据各物质的式量总和可知质量比:32 32+16×2=64 已知量和未知量 3.2g x 根据比例关系列出计算式: 解得 x=6.4g 答:生成二氧化硫的质量为6.4g. |
提示:
|
【设计意图】考查根据化学方程式计算的基本格式的掌握情况. |

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
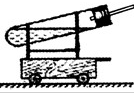 (2009?杭州)
(2009?杭州)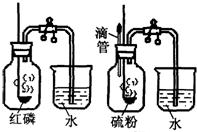 “空气中氧气含量的测定”有多种方法.甲生设计了如图所示的实验方案:在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温,打开铁夹,水注入集气瓶.回答下列问题:
“空气中氧气含量的测定”有多种方法.甲生设计了如图所示的实验方案:在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温,打开铁夹,水注入集气瓶.回答下列问题: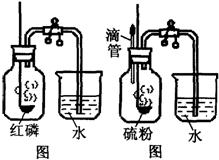 21、“空气中氧气含量的测定”有多种方法.甲生设计了如下左图所示的实验方案:在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温,打开铁夹,水注入集气瓶.回答下列问题:
21、“空气中氧气含量的测定”有多种方法.甲生设计了如下左图所示的实验方案:在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温,打开铁夹,水注入集气瓶.回答下列问题:
