题目内容
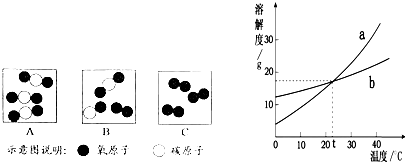
 a、b两物质的溶解度曲线如图,请根据图示回答:
a、b两物质的溶解度曲线如图,请根据图示回答:
(1)30℃时,a的溶解度是________ g;
(2)a的溶解度小于b的溶解度的温度范围是________℃;
(3)20℃时,在100g水中加入50g a物质,充分溶解后,所得溶液中溶质的质量分数是________;
(4)将30℃等质量的a、b两物质的饱和溶液同时降温到20℃,所得a溶液中溶质的质量分数________b溶液中溶质的质量分数(填“大于”或“等于”或“小于”);
(5)现有两试管,分别盛有等质量的20℃的a、b两物质的饱和溶液,试管底部有等质量的a、b剩余,将两试管放入盛有20℃水的烧杯中,然后向烧杯的水中加入氢氧化钠固体(如图).则对相关变化判断正确的是________(不考虑溶剂的蒸发,析出的固体不含水)
A.a溶液中溶质质量增多,b溶液中溶质质量减少
B.a溶液中溶质质量分数小于b溶液中溶质质量分数
C.a溶液中溶剂质量小于b溶液中溶剂质量
D.试管底部a固体的质量小于b固体的质量.
解:(1)由a物质的溶解度曲线可以查出,30℃时,a的溶解度是40 g;
(2)由a、b两物质的溶解度曲线可以看出,在温度小于20℃时,a的溶解度小于b的溶解度;
(3)由a物质的溶解度曲线可以查出,20℃时,a的溶解度是25g;由溶解度的含义可知,在100g水中加入50g a物质,充分溶解后,只能溶解25g.所得溶液中溶质的质量分数是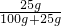 ×100%=20%;
×100%=20%;
(4)由a、b两物质的溶解度曲线可知,a物质的溶解度随温度的降低而减小,b物质的溶解度随温度的降低而增大,所以.将30℃时等质量的a、b两物质的饱和溶液同时降温到20℃时,a物质的饱和溶液有晶体析出,成为20℃的饱和溶液,b物质的饱和溶液变为不饱和溶液,溶液的溶质质量分数就是30℃时饱和溶溶液的溶质质量分数,由于在20℃时a的溶解度大于b在30℃时的溶解度.所以,所得a溶液中溶质的质量分数大于b溶液中溶质的质量分数;
(4)由a、b两物质的溶解度曲线可知,a物质的溶解度随温度的降低而减小,b物质的溶解度随温度的降低而增大,由于氢氧化钠溶于水时溶液的温度升高,由此可知:
A.a溶液中溶质质量增多,b溶液中溶质质量减少.故A正确;
B.由于在温度大于20℃时,a的溶解度大于b的溶解度.a溶液中溶质质量分数大于b溶液中溶质质量分数.故B错误;
;
C.溶液中溶剂质量不变.故C错误;
D.试管底部a固体的质量小于b固体的质量.故D正确.
故答为:(1)40; (2)小于20; (3)20%;(4)大于; (5)AD.
分析:(1)根据溶解曲线,查出30℃时,a的溶解度;
(2)根据a、b两物质的溶解度曲线,比较溶解度的大小;
(3)根据20℃时,a物质的溶解度分析计算;
(4)根据a、b两物质的溶解度随温度的变化及溶解度与溶质质量分数的关系分析;
(5)根据氢氧化钠溶于水时溶液的温度升高,再结合a、b两物质的溶解度随温度的变化分析.
点评:本题较全面地考查了溶解度曲线的意义.根据曲线的横、纵坐标分别表示什么意义,明确曲线的趋势、陡度及其含义,理解曲线上的点和其它位置的点所表示的意义,来解答题目.锻炼了创新思维和整合知识的能力.
(2)由a、b两物质的溶解度曲线可以看出,在温度小于20℃时,a的溶解度小于b的溶解度;
(3)由a物质的溶解度曲线可以查出,20℃时,a的溶解度是25g;由溶解度的含义可知,在100g水中加入50g a物质,充分溶解后,只能溶解25g.所得溶液中溶质的质量分数是
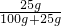 ×100%=20%;
×100%=20%;(4)由a、b两物质的溶解度曲线可知,a物质的溶解度随温度的降低而减小,b物质的溶解度随温度的降低而增大,所以.将30℃时等质量的a、b两物质的饱和溶液同时降温到20℃时,a物质的饱和溶液有晶体析出,成为20℃的饱和溶液,b物质的饱和溶液变为不饱和溶液,溶液的溶质质量分数就是30℃时饱和溶溶液的溶质质量分数,由于在20℃时a的溶解度大于b在30℃时的溶解度.所以,所得a溶液中溶质的质量分数大于b溶液中溶质的质量分数;
(4)由a、b两物质的溶解度曲线可知,a物质的溶解度随温度的降低而减小,b物质的溶解度随温度的降低而增大,由于氢氧化钠溶于水时溶液的温度升高,由此可知:
A.a溶液中溶质质量增多,b溶液中溶质质量减少.故A正确;
B.由于在温度大于20℃时,a的溶解度大于b的溶解度.a溶液中溶质质量分数大于b溶液中溶质质量分数.故B错误;
;
C.溶液中溶剂质量不变.故C错误;
D.试管底部a固体的质量小于b固体的质量.故D正确.
故答为:(1)40; (2)小于20; (3)20%;(4)大于; (5)AD.
分析:(1)根据溶解曲线,查出30℃时,a的溶解度;
(2)根据a、b两物质的溶解度曲线,比较溶解度的大小;
(3)根据20℃时,a物质的溶解度分析计算;
(4)根据a、b两物质的溶解度随温度的变化及溶解度与溶质质量分数的关系分析;
(5)根据氢氧化钠溶于水时溶液的温度升高,再结合a、b两物质的溶解度随温度的变化分析.
点评:本题较全面地考查了溶解度曲线的意义.根据曲线的横、纵坐标分别表示什么意义,明确曲线的趋势、陡度及其含义,理解曲线上的点和其它位置的点所表示的意义,来解答题目.锻炼了创新思维和整合知识的能力.

练习册系列答案
相关题目
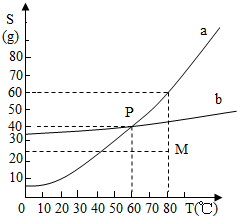 如如图所示为a、b两物质的溶解度曲线,下列根据如图所示中M点和P点,得到的正确信息是( )
如如图所示为a、b两物质的溶解度曲线,下列根据如图所示中M点和P点,得到的正确信息是( )| A、60℃时,a、b两物质饱和溶液的质量分数都为40% | B、80℃时,100g水中溶解25g的a的物质,溶液不饱和 | C、80℃时,将a、b两物质的饱和溶液降温到20℃时,只有a物质析出 | D、向M点的任意量a溶液中,加入(60-25)g溶质,溶液一定达到饱和 |
 25、如图为a、b、c三种物质的溶解度曲线.
25、如图为a、b、c三种物质的溶解度曲线.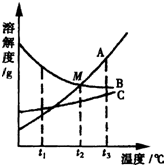 25、A、B、C三种物质的溶解度曲线如右图所示,请回答:
25、A、B、C三种物质的溶解度曲线如右图所示,请回答: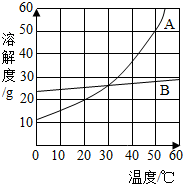 (2012?集美区质检)如图是A、B两种固体物质的溶解度随温度变化的曲线.请回答:
(2012?集美区质检)如图是A、B两种固体物质的溶解度随温度变化的曲线.请回答: