题目内容
10.25g石灰石与146g稀盐酸恰好完全反应(杂质不参加反应)反应后残余物质量为162.2g.求:①生成二氧化碳的质量;
②石灰石中碳酸钙的质量分数.
分析 根据碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳;根据质量守恒定律,试管中质量的减少的质量即生成的二氧化碳质量,据此根据反应的化学方程式列式计算出生成的碳酸钙的质量,进而计算出石灰石中含碳酸钙的质量分数.
解答 解:①由质量守恒定律,生成二氧化碳气体的质量为25g+146g-162.2g=8.8g;
②设原石灰石中CaCO3的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 8.8g
$\frac{100}{x}=\frac{44}{8.8g}$
x=20g
石灰石中CaCO3的质量分数为:$\frac{20g}{25g}$×100%=80%.
答:①反应中生成的CO2质量为8.8g.
②石灰石中CaCO3的质量分数为80%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出二氧化碳的质量是正确解答本题的前提和关键.

练习册系列答案
相关题目
1.现有H2SO4、NaOH、CuO、Na2CO3、CO2五种物质,分别与其他物质反 应.都有同一种物质X生成,则X的化学式可能是下列物质中的( )
| A. | 02 | B. | H2O | C. | NaCl | D. | Na2S04 |
15.如图所示的化学实验基本操作正确的是( )
| A. |  氧气的验满 | B. |  取用固体药品 | C. |  量取35毫升液体 | D. |  加热液体 |
2.配置一定质量分数的氯化钠溶液时,下列实验操作会引起溶质的质量分数降低的是( )
| A. | 称氯化钠固体时,氯化钠放入左盘 | |
| B. | 用量筒量水时,面对刻度仰视凹液面的最低处读数 | |
| C. | 将量筒内的水倒入烧杯时,有水溅出 | |
| D. | 将配好的溶液倒入细口瓶时,不慎洒落 |


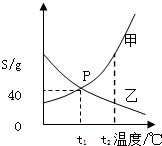 甲、乙两物质的溶解度曲线如图所示,请据图回答下列问题.
甲、乙两物质的溶解度曲线如图所示,请据图回答下列问题.