题目内容
【题目】我国第一艘国产航母的许多电子元件使用了黄铜(假设合金中仅含铜,锌),兴趣小组同学向盛有30g黄铜样品的烧杯中逐渐加入稀硫酸,生成氢的质量与加入稀硫酸的质量关系如图所示,计算:
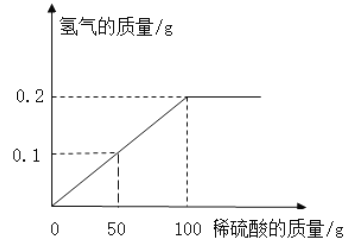
(1)充分反应后生成氢气的质量为_____g
(2)合金样品中铜的质量。_____
(3)恰好完全反应时,所得溶液中溶质的质量分数。_____ (结果保留到0.1%)
【答案】0.2g 23.5g 15.1%
【解析】
铜和稀硫酸不反应,锌和稀硫酸反应生成硫酸锌和氢气。
解:根据图可知生成的氢气的质量为0.2g。
设合金样品中锌的质量为x,充分反应后生成硫酸锌的质量为y,
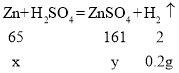
![]()
解得:x=6.5g,y=16.1g,合金样品中铜的质量30g-6.5g=23.5g,
恰好完全反应后所得溶液溶质的质量分数:![]() 15.1%。
15.1%。
答:(1)充分反应后生成氢气的质量为 0.2g。
(2)合金样品中铜的质量为23.5g
(3)恰好完全反应时所得溶液溶质的质量分数为15.1%。

练习册系列答案
相关题目
【题目】下列说法完全正确的是( )
A | 氖气的化学式—— 1个硅原子—— 1个钠离子--- | B | 决定元素种类——质子数 决定元素化学性质——最外层电子数 决定元素在周期表中的周期序数——电子层数 |
C | 铁——由分子构成 二氧化碳——由原子构成 硫酸铜——由离子构成 | D | 分子——化学变化中的最小粒子 原子——保持物质化学性质的最小粒子 离子——带电的原子或原子团 |
A. AB. BC. CD. D