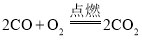题目内容
【题目】钼是一种重要的金属,用它制成的合金有良好的机械性能,在工农业生产和国防上都有广泛的用途,下图是利用钼矿石(主要成分为MoS2)制备金属钼的流程图 :
信息:MoO3+3H2![]() Mo+3H2O
Mo+3H2O
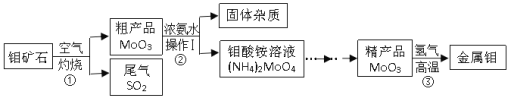
请回答下列问题:
(1)反应①常将钼矿石粉碎,目的是____;MoO3中钼元素的化合价为_____。
(2)操作Ⅰ的名称是____;常用NaOH溶液吸收反应①的尾气,化学方程式为_______。
(3)制得19.2吨金属钼,理论上至少需含MoO380%的粗产品___________吨?请写出计算过程。
【答案】增大反应物间的接触面积,使反应充分进行或加快反应速率 +6 过滤 2NaOH+SO2=Na2SO3+H2O 36
【解析】
(1)反应④常将钼矿石粉碎,由于反应物接触面积越大反应越快,转化率越高,所以目的是提高转化速率和转化率;MoO3中氧元素的化合价为-2价,根据化合物中正负化合价的代数和为零可得钼元素的化合价为+6。故填:增大反应物间的接触面积,使反应充分进行或加快反应速率;+6
(2)操作I得到固体和液体,所以是过滤;常用NaOH溶液吸收反应①的尾气,是二氧化硫和氢氧化纳反应生成亚硫酸钠和水,对应的化学方程式为2NaOH+SO2=Na2SO3+H2O;故填:过滤;2NaOH+SO2=Na2SO3+H2O
(3)设制得19.2吨金属钼,理论上至少需含MoO380%的粗产品的质量为x。

![]()
![]() ;故填:36
;故填:36

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目