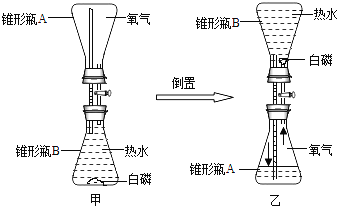
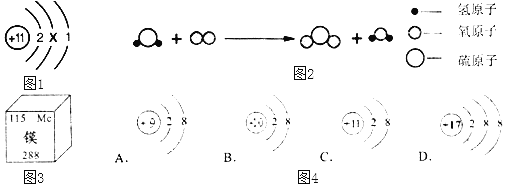
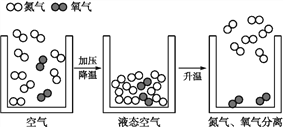
题目内容
【题目】常温下,氯酸钾的溶解度较小,在工业上可通过如下工艺流程制得。
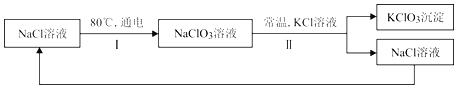
(1)写出实验室加热KClO3和二氧化锰的混合物制备氧气的化学方程式:_____。
(2)反应I中,通电时发生的反应方程式为:NaCl+3X![]() NaClO3+3H2↑,则X的化学式为_____。
NaClO3+3H2↑,则X的化学式为_____。
(3)反应Ⅱ的反应方程式为:_____。
(4)该流程中可以循环利用的物质是NaCl,从微观角度探析NaCl是由_____ 构成(用化学用语表示)。
【答案】 2KClO3![]() 2KCl+3O2↑ H2O NaClO3+KCl═KClO3↓+NaCl Na+和Cl﹣
2KCl+3O2↑ H2O NaClO3+KCl═KClO3↓+NaCl Na+和Cl﹣
【解析】(1)氯酸钾在二氧化锰作催化剂的条件下加热生成氯化钾和氧气,反应方程式为:2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
(2)根据质量守恒定律,生成物中有1个钠原子,1个氯原子,3个氧原子,6个氢原子,反应物中已经有1个钠原子,1个氯原子,故3X中有3个氧原子和6个氢原子,故X中有2个氢原子和1个氧原子,化学式为H2O;
(3)氯酸钠和氯化钾反应生成氯酸钾和氯化钠,反应方程式为:NaClO3+KCl═KClO3↓+NaCl;
(4)氯化钠是由钠离子和氯离子构成的,表示为:Na+和Cl﹣;

 名校课堂系列答案
名校课堂系列答案【题目】某小组在学习“二氧化碳与氢氧化钠溶液反应”时,进行了如下探究。
【提出问题】二氧化碳与氢氧化钠反应,还是溶解在水中?
【查阅资料】①15℃、101kPa时,二氧化碳的溶解度如下:
溶剂 | 水 | 酒精 |
溶解度 | 1.0 | 0.5 |
②15℃时,在酒精中氢氧化钠易溶,碳酸钠微溶。
③通常情况下,稀溶液的体积约等于溶剂的体积。
【实验设计】在15℃、101kPa时,制取二氧化碳并用于实验甲、实验乙。

【分析与表达】
(1)如果二氧化碳与氢氧化钠反应,化学方程式是______________________________,那么氢氧化钠应______________保存。
(2)实验前,两套装置都进行气密性检查,实验甲装置气密性检查的方法是__________。
(3)实验甲中,同时滴入等体积的水和氢氧化钠溶液后的现象是__________。
(4)实验乙中,将氢氧化钠完全滴入锥形瓶中,注射器会自动向内移动并将酒精推入锥形瓶,活塞的移动速度是________(填答案字母)。
A.先慢后快 B.先快后慢 C.先慢后快,再变慢
实验乙中,还可能观察到的现象是________________________________________。
(5)实验乙中,120mL酒精____________(选填“能”或“不能”)换成水,原因是_____________________。
(6)由以上探究可知,二氧化碳能溶于水,也能与氢氧化钠反应,但实验乙的数据还不够准确,造成实验乙误差的原因可能有___________________。(写一条)