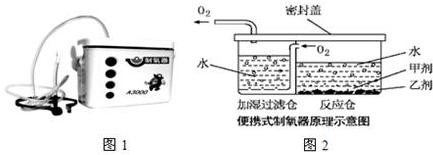
题目内容
右图为甲、乙两固体物质的溶解度曲线,依据溶解度曲线指出下列说法中错误的是( )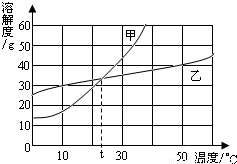
A.30℃时甲物质的溶解度比乙物质的溶解度大
B.若甲中混有少量乙,则可采用冷却热饱和溶的方法提取乙
C.t℃时甲、乙两物质的饱和溶液中溶质的质量分数相等
D.它们的溶解度都随温度升高而增大
A、某温度时,对比两物质的溶解度大小;
B、能否选择冷却热饱和溶液的方法分离两物质的混合物;
C、比较两物质在同一温度时的饱和溶液中溶质的质量分数;
D、比较两物质溶解度随温度变化而变化的情况是否一致.
解答:答:A、在温度为30℃时,图中乙物质曲线处于甲物质曲线下方,说明此时甲物质的溶解度大于乙物质.本选项说法正确;
B、曲线图显示,甲物质溶解度爱温度影响较大,乙物质的溶解度受温度影响不大.当甲物质中混有少量乙物质时,可采用冷却热饱和溶液的方法提纯甲,冷却结晶时少量的乙物质仍溶解在溶液中没有析出.本选项说法错误;
C、曲线图显示,在温度为t℃时两曲线相交于一点,说明此时甲、乙两物质的溶解度相等.此时两物质的饱和溶液中溶质与溶剂的质量比相同,溶质质量分数就是溶液中溶质与溶液的质量之比,所以两物质的饱和溶液溶质质量是相等的.本选项的说法正确;
D、曲线图显示,甲物质溶解度随温度升高而增大较快,乙物质的溶解度随温度升高增大不大,两物质的溶解度都在随温度升高而增大.此选项说法正确.
故选B
点评:物质溶解度受温度影响,溶解度曲线的“坡度”越大说明物质溶解能力受温度影响越大.

过氧化钠(Na2O2)是一种淡黄色固体。在一次科技活动中,同学们将包有Na2O2固体的棉花放入了如右图所示的装置中,发现高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭,同时也惊奇地发现棉花燃烧了起来。
(1)实验过程中蜡烛由下往上依次熄灭,说明二氧化碳
具有 的性质。
(2)棉花为什么会燃烧呢?同学们认为棉花要燃烧,除了满足棉花是可燃物之外,还需
满足 、  。
。
【提出问题】上述实验中是如何给棉花提供燃烧条件的?
【查阅资料】1.在常温下Na2O2与CO2、H2O均能发生化学反应。
2.无水硫酸铜为白色固体,吸水后变为蓝色。
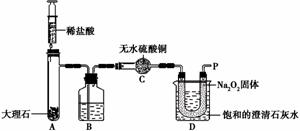
【实验设计】经过讨论,同学们设计用下图所示装置进行实验探究。
 | |||
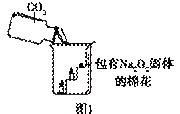 | |||
【实验步骤】①检查整套装置的气密性; ②把相关的试剂放入对应的仪器内;
③用力推动针筒的活塞,把稀盐酸注入试管内;
④一段时间后,在P处放 置一根带火星的木条,观察现
置一根带火星的木条,观察现 象。
象。
注意:大理石与稀盐酸制取的CO2还会含有一定量的水蒸气,但整个实验过程中不考虑稀盐酸的挥发和空气对实验的影响。
【实验现象】
①带火星的木条复燃; ②无水硫酸铜没有变蓝色; ③饱和的澄清石灰水变浑浊。
【实验分析】①B装置内盛放的试剂是 ;②D装置烧杯内澄清石灰水变浑浊的原因可能是 ,也可能是空气中的CO2与澄清石灰水反应生成了难溶物使澄清石灰水变混浊。
【实 验结论】
验结论】 ①Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件。
①Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件。
②Na2O2和CO2反应过程中伴随能量变化,使图1中的棉花满足了燃烧的另一个条件。
【拓展提高】①Na2O2和CO2反应除生成一种气体外,还生成了一种固体,学生甲认为生成的固体是NaOH,学生乙认为是Na2CO3,同学们经思考后认为甲同学的猜想是错误的,理由是 。
②写出Na2O2和CO2反应的化学方程式  。
。
【定量探究】有一包久置的过氧化钠粉末,现已证明因其保存不当导致完全变质成为NaOH和Na2CO3的混合物,同学们称取了13.25g样品,加入足量稀盐酸,并将产生的气体通入足量的澄清石灰水中,得到白色沉淀,经过滤、洗涤、烘干后称得其质量为10g,试计算:样品中Na2CO3的质量分数。