题目内容
【题目】木炭还原氧化铜实验后的混合粉末中含有铜、氧化铜、木炭粉,某化学小组同学设计回收铜的方案如下:
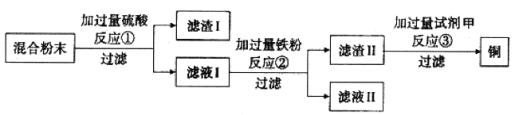
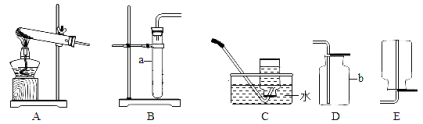
①过滤操作中必须用到的玻璃仪器有:烧杯、玻璃棒和(12) ,其中玻璃棒的作用是(13) 。
②反应①的化学方程式为(14) 。
③反应②属于(15) 反应(填写基本反应类型),滤液II中的溶质为(16) (填写化学式)。
④若从H2SO4和CuSO4中选择试剂甲,最好选用H2SO4,合理的原因是(17) (填写序号)。
A.可以将硫酸铜变为铜
B.自然界中硫酸比硫酸铜多,容易获得
C.用硫酸铜反应一段时间后,铁表面有铜会阻碍铁的溶解
D.不用硫酸铜,因为过量硫酸铜会造成重金属污染
⑤试剂甲选用硫酸,实验过程中,当看到(18) (填写现象),即可判断硫酸过量。
【答案】(12)漏斗
(13)引流
(14)CuO+H2SO4==CuSO4+H2O
(15)置换
(16)FeSO4
(17)D
(18)不再产生气泡时
【解析】
试题分析:①过滤时需要的仪器有:铁架台、漏斗、烧杯、玻璃棒;其中玻璃棒是起引流是作用;
②铜、氧化铜、木炭粉这三种物质中只有氧化铜能与稀硫酸反应生成硫酸铜和水:CuO+H2SO4==CuSO4+H2O;
③通过过滤操作后,滤渣的主要成分是铜和木炭粉,滤液的主要成分是硫酸铜,加入过量的铁粉,铁能与硫酸铜发生置换反应生成铜和硫酸亚铁,对所得物质进行过滤,滤渣的主要成分是铜和铁,滤液的主要成分是硫酸亚铁;
④由于滤渣2的主要成分是铜和铁,要把铁除去,虽然两种物质均能与铁发生反应,但由于过量硫酸铜会造成重金属污染,故选择硫酸;
⑤铁与硫酸反应生成硫酸亚铁和氢气,当没有气泡产生时说明铁完全反应。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目