题目内容
 按要求完成下列小题:
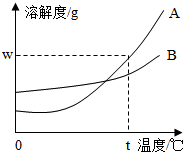
按要求完成下列小题:(1)如图所示,A、B两种固体物质的溶解度曲线:
①A、B两种物质的溶解度都随温度的升高而
②已知t℃时,A物质的溶解度为wg.则t℃时,A物质饱和溶液中溶质质量分数可以表示为
(2)现有两瓶失去标签的溶液,溶质分别可能是硝酸钠、硝酸铜、硝酸、硫酸钠、硫酸、碳酸钾中的一种,检验步骤如下:
Ⅰ.分别取少量混合,无明显现象,溶液无色透明,经测定混合溶液显酸性.由此可推断这两瓶溶液中的溶质一定不是
Ⅱ.向上述混合溶液中加入Ba(NO3)2溶液,产生白色沉淀.则这两瓶溶液中的溶质至少是
(3)将A、B、C三种物质各8g混合,一定条件下充分反应后,测得混合物中有6gA、13.5gC和一定质量的D,B完全反应.若A、B、C、D的相对分子质量之比为8:16:22:9,则该反应的化学方程式可表示为
考点:固体溶解度曲线及其作用,溶质的质量分数、溶解性和溶解度的关系,酸、碱、盐的鉴别,书写化学方程式、文字表达式、电离方程式
专题:物质的鉴别题,化学用语和质量守恒定律,溶液、浊液与溶解度
分析:(1)根据物质的溶解度曲线可以判断物质的溶解度随着温度的变化而变化的情况;
饱和溶液的溶质质量分数=
×100%;
(2)硝酸铜溶液蓝色的,碳酸钾溶液显碱性;
钡离子和硫酸根离子能够结合成不溶于酸的白色沉淀--硫酸钡;
(3)合成反应遵循质量守恒定律,根据质量守恒定律及其相关数据可以判断反应的化学方程式.
饱和溶液的溶质质量分数=
| 溶解度 |
| 100g+溶解度 |
(2)硝酸铜溶液蓝色的,碳酸钾溶液显碱性;
钡离子和硫酸根离子能够结合成不溶于酸的白色沉淀--硫酸钡;
(3)合成反应遵循质量守恒定律,根据质量守恒定律及其相关数据可以判断反应的化学方程式.
解答:解:(1)①A、B两种物质的溶解度都随温度的升高而增大,其中溶解度受温度影响较大的是A物质.
故填:增大;A.
②已知t℃时,A物质的溶解度为wg.则t℃时,A物质饱和溶液中溶质质量分数为:
×100%=
%.
故填:
.
(2)Ⅰ.因为混合溶液无色透明,经测定混合溶液显酸性,所以这两瓶溶液中的溶质一定不是硝酸铜和碳酸钾,因为硝酸铜溶液是蓝色的,碳酸钾溶液显碱性.
故填:Cu(NO3)2、K2CO3.
Ⅱ.向上述混合溶液中加入Ba(NO3)2溶液,产生白色沉淀,则这两瓶溶液中的溶质至少是硫酸钠、稀硫酸中的一种,因为只有硫酸钠或稀硫酸能和硝酸钡反应生成不溶于酸的沉淀--硫酸钡.
故填:Na2SO4、H2SO4.
(3)测得混合物中有6gA,则参加反应的A的质量为:8g-6g=2g;
测得混合物中有13.5gC,则反应生成C的质量为:13.5g-8g=5.5g;
由分析可知,反应物是A和B,生成物是C和D,反应生成D的质量为:2g+8g-5.5g=4.5g;
设A、B、C、D的化学计量数分别是x、y、z、m,
则有:8x:16y:22z:9m=2g:8g:5.5g:4.5g,
x:y:z:m=1:2:1:2,
因此该反应的化学方程式为:A+2B
C+2D.
故填:A+2B
C+2D.
故填:增大;A.
②已知t℃时,A物质的溶解度为wg.则t℃时,A物质饱和溶液中溶质质量分数为:
| wg |
| 100g+wg |
| 100w |
| 100+w |
故填:
| 100w |
| 100+w |
(2)Ⅰ.因为混合溶液无色透明,经测定混合溶液显酸性,所以这两瓶溶液中的溶质一定不是硝酸铜和碳酸钾,因为硝酸铜溶液是蓝色的,碳酸钾溶液显碱性.
故填:Cu(NO3)2、K2CO3.
Ⅱ.向上述混合溶液中加入Ba(NO3)2溶液,产生白色沉淀,则这两瓶溶液中的溶质至少是硫酸钠、稀硫酸中的一种,因为只有硫酸钠或稀硫酸能和硝酸钡反应生成不溶于酸的沉淀--硫酸钡.
故填:Na2SO4、H2SO4.
(3)测得混合物中有6gA,则参加反应的A的质量为:8g-6g=2g;
测得混合物中有13.5gC,则反应生成C的质量为:13.5g-8g=5.5g;
由分析可知,反应物是A和B,生成物是C和D,反应生成D的质量为:2g+8g-5.5g=4.5g;
设A、B、C、D的化学计量数分别是x、y、z、m,
则有:8x:16y:22z:9m=2g:8g:5.5g:4.5g,
x:y:z:m=1:2:1:2,
因此该反应的化学方程式为:A+2B
| ||
故填:A+2B
| ||
点评:化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、进行相关方面计算的基础.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列实验操作中,正确的是( )
A、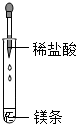 |
B、 |
C、 |
D、 |
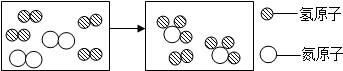
 实验室配制氯化铵(NH4Cl)溶液不能使用硬水,因硬水中含有较多的
实验室配制氯化铵(NH4Cl)溶液不能使用硬水,因硬水中含有较多的