题目内容
【题目】金属材料与人类的生产和生活密切相关.
(1)铜块可以制成铜丝是利用了铜的_____性;
(2)铁生锈的条件是_____;
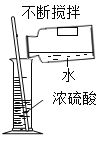
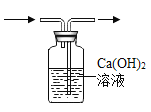
(3)某化学兴趣小组的同学想从含有Al2(SO4)3、CuSO4的废液中回收金属铜,设计了如下实验:
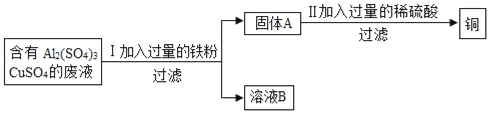
①Ⅰ中有关反应的化学方程式_____;
②Ⅱ中加入过量的稀硫酸的目的是_____.
【答案】延展性 与氧气和水同时反应 Fe+CuSO4═FeSO4+Cu 除去铜粉中混有的铁粉
【解析】
(1)铜块可以制成铜丝是利用了铜的延展性;
(2)金属的锈蚀是铁与空气的氧气、水共同作用的结果;
(3)铁会置换出硫酸铜中的铜,不会置换出硫酸铝中的铝,过量的铁会与稀硫酸反应,所以
①I中发生的反应是铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4═FeSO4+Cu;
②溶液B中所含的溶质是A12(SO4)3、FeSO4;
③II中加入过量的稀硫酸的目的是除去铜粉中混有的铁粉.
故答案为(1)延展;(2)与氧气和水同时反应;(3)①Fe+CuSO4═FeSO4+Cu;②除去铜粉中混有的铁粉.

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】某校化学兴趣小组的小王和小张两位同学根据已有知识经验。对敞口放置在实验室的Na OH溶液产生了兴趣。分别进行实验探究。
[提出问题]:
这瓶Na OH溶液肯定变质了,其变质程度怎样呢?
[猜想与假设]:
小王:Na OH溶液部分变质;小张:Na OH溶液全部变质;
小王、小张认为Na OH溶液一定变质的理由(用化学方程式表示)______。
[进行实验]:
(1)小王设计好方案后,进行了如下实验来验证自己的猜想,请你协助小王完成实验现象的填写:
实验步骤 | 现象 | 结论 |
①取一定量Na OH溶液样品于试管中,滴加足量BaCl2溶液 | 有______产生 | Na OH溶液样品部分变质 |
②取经过①反应后的滤液,向其中滴加紫色石蕊溶液 | 溶液变成______色 |
(2)小张取用小王第①步反应后的滤液,滴加CuCl2溶液,有______色沉淀产生,证明自己猜想错误。
[反思与评价]:
(1)如果Na OH溶液中混有少量Na2CO3杂质,常加入适量______(填物质的化学式)。
(2)小王、小张通过以上探究分析推出,实验室保存Ba(OH)2溶液的方法应该是______。