题目内容
【题目】化学小组在老师的指导下,完成了一个兴趣实验。向包有Na2O2的脱脂棉中吹气,发现脱脂棉剧烈燃烧起来。于是他们决定探究脱脂棉燃烧的原因。请你参与他们的探究。
【提出问题】脱脂棉为什么会燃烧?
【查阅资料】
1.Na2O2是一种淡黄色固体,常温下能与CO2、H2O、HCl气体等物质发生反应,不能与N2发生反应。
2.人呼出的气体的主要成分及含量:N2:74%;O2:16%;水蒸气:6%;CO2:4%
3.CO2既不与NaHCO3反应,也不溶于饱和的NaHCO3溶液。
【猜想与假设】
1.可能是CO2与Na2O2反应产生了O2,释放出热量。
2.可能是H2O与Na2O2反应产生了O2,释放出热量。
3.可能是_______与Na2O2反应产生了O2,释放出热量。
【实验验证】
实验I:验证CO2与Na2O2反应产生了O2,释放出热量。
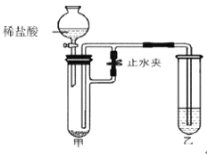
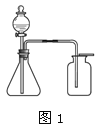
甲小组同学用图1所示装置(部分夹持装置略去)制取并收集了一瓶CO2气体,将包有Na2O2的脱脂棉放在燃烧匙中,伸入集气瓶,观察到脱脂棉剧烈燃烧。得出结论,猜想1成立。乙小组同学认为上述实验不足以证明CO2与Na2O2反应产生了O2,理由是__________。
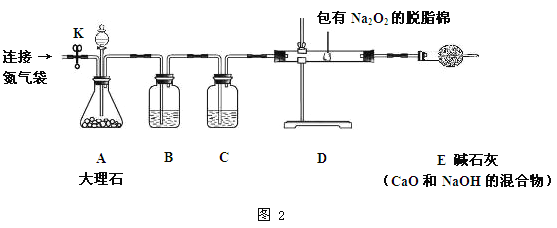
同学们经过讨论,对上述实验方案进行了改进,用图2所示的装置(部分夹持装置略去)进行实验验证猜想1成立。打开止水夹K,鼓入纯净、干燥的氮气一段时间后,关闭止水夹K。注入稀盐酸,观察到脱脂棉剧烈燃烧。
【解释与结论】
1.装置A中发生反应的化学方程式为________________。
2.装置B的作用是__________________。
3.装置C中盛放的药品是___________,作用是__________________。
实验II:验证H2O与Na2O2反应产生了O2,释放出热量。
请你设计一个实验方案,验证H2O与Na2O2反应产生了O2,释放出热量(写出实验步骤、现象及结论)___________。
【答案】【猜想与假设】3. CO2、H2O(或H2CO3)
【实验验证】实验I:理由是:制得的CO2中混有H2O 、HCl气体,也可能与Na2O2发生反应产生O2。
【解释与结论】1.CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
2.除去CO2中混有的HCl
3.浓硫酸,除去CO2中混有的H2O
实验II:取适量Na2O2于锥形瓶中,加入适量蒸馏水,观察到锥形瓶壁上有大量水雾产生,说明H2O与Na2O2反应释放出热量;将带火星的木条放入中,木条复燃,说明H2O与Na2O2反应产生O2。(2分,答案合理即可)
【解析】
试题分析:【猜想与假设】3也可能是人呼出的气体中的二氧化碳、水共同与Na2O2反应产生了O2,释放出热量。
【实验验证】用图1装置制取二氧化碳气体,会含有水蒸气和氯化氢气体。所以可能是二者中的物质与Na2O2反应产生了O2。
【解释与结论】1.装置A中发生反应是稀盐酸与大理石中的碳酸钙反应生成二氧化碳,
化学方程式为CaCO3 + 2HCl === CaCl2 + H2O + CO2↑。
2.为排除水蒸气和氯化氢气体的影响,装置B需要除去的是盐酸挥发出的氯化氢气体。
3.为排除水蒸气和氯化氢气体的影响,装置C需要除去的是气体中混有的水蒸气,应盛放的药品是浓硫酸。
实验II:为验证H2O与Na2O2反应产生了O2,释放出热量。可将适量Na2O2置于一容器(锥形瓶)中,再加入适量蒸馏水,如观察到瓶壁上有水雾或触摸瓶壁感觉到热,则证明二者反应会放热。再将带火星的木条伸入其中,会观察到木条复燃,说明二者反应会生成氧气。实验设计的关键在于两点:1、能通过实验现象说明二者反应会放出热量;2、能验证二者反应的生成物为氧气。