题目内容
【题目】将一定质量的金属锌投入63.7g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示.试求(计算结果精确到0.1%):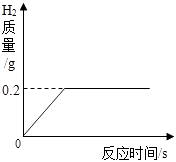
(1)完全反应后生成氢气的质量为g
(2)所用硫酸溶液中溶质的质量分数
(3)反应结束后所得溶液的质量.
【答案】
(1)0.2
(2)解:设参加反应锌、硫酸溶液中溶质的质量分别为x、y
Zn+ | H2SO4= ZnSO4+ | H2↑ |
65 | 98 | 2 |
x | y | 0.2g |
![]()
解得:x=6.5g y=9.8g
所用硫酸溶液中溶质的质量分数为: ![]() ×100%=15.4%
×100%=15.4%
(3)解:由质量守恒定律可知,反应结束后所得溶液的质量为:63.7g+6.5g﹣0.2g=70g。
【解析】解:(1)由放出气体的质量与反应时间的关系图可知,生成氢气的质量为0.2g;再根据质量守恒定律即可算出相关物质真的质量。
故答案为:(1)0.2g;
解:设参加反应锌、硫酸溶液中溶质的质量分别为x、y
Zn+ | H2SO4= ZnSO4+ | H2↑ |
65 | 98 | 2 |
x | y | 0.2g |
![]()
解得:x=6.5g y=9.8g
所用硫酸溶液中溶质的质量分数为: ![]() ×100%=15.4%
×100%=15.4%
所用硫酸溶液中溶质的质量分数是15.4%;
(3)由质量守恒定律可知,反应结束后所得溶液的质量为:63.7g+6.5g﹣0.2g=70g。
本题主要考察化学反应中物质质量关系,在化学反应中,参加反应的物质质量之比灯油相对分子质量乘以化学计量数之比。溶质质量分数等于溶质质量与溶液质量的比值。

练习册系列答案
相关题目
【题目】物质的种类丰富多彩,下表物质与物质的分类完全正确的是( )
物质 | 物质的分类 | |
A | 四氧化三铁、氧气、二氧化碳 | 氧化物 |
B | 硫酸铜、盐酸、碳酸 | 酸 |
C | 氢氧化钠、氢氧化钙、盐水 | 碱 |
D | 氯化钠、碳酸钠、碳酸钙 | 盐 |
A.AB.BC.CD.D
