题目内容
【题目】冰冰同不害超市购买的袋装薯片中意外发现有一个小袋,上面标有“成分:CaO、Fe”;作用:防潮、防氧化;警告:禁止食用”等字样,撕开小袋,发现里面的固体粉末有少许是棕红色的,大多数是灰白色的.经过分析,她认为棕红色粉末是Fe2O3 , 灰白色粉末应该含有CaCO3和Fe,为验证自己的判断,小丽打算进行实验探究,请你一同参与.
【实验目的】证实灰白色粉末中含有CaCO3和Fe.
【查阅资料】①氢气具有还原性,能夺取某些金属氧化物中的氧,使金属还原,②白色的无水硫酸铜遇水变成蓝色.
[实验设计]装置如图所示: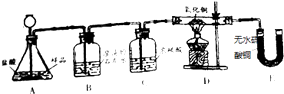
【实验预测与分析】
(1)若要证实样品中含有CaCO3 , B中观察到的实验现象是 , B中发生反应的化学方程式为 . 若要证实样品中含有Fe,D中应观察到的实验现象是 , E中应观察到白色固体变成蓝色.
(2)A中反应产生气体单质的化学方程式为 .
(3)有同学认为小袋内灰白色粉末中还应该有别的物质,请你写出其中其中不属于氧化物的化学式 . 为了验证该物质的存在,有同学取一部分袋内灰白色粉末加水充分溶解、过滤,再向滤液中滴加 , 若液体变红色,则证明了该物质的存在.
(4)冰冰认为棕红色粉末Fe2O3也能与盐酸反应,请你写出反应的化学方程式
(5)有同学认为应在E装置后增加盛有的洗气瓶.才使实验更有说服力.
【答案】
(1)澄清的石灰水变浑浊;CO2+Ca(OH)2=CaCO3↓+H2O;黑色固体变成红色
(2)Fe+2HCl=FeCl2+H2↑
(3)Ca(OH)2 ;酚酞溶液
(4)Fe2O3+6HCl=2FeCl3+3H2O
(5)浓硫酸
【解析】解:(1)若样品中含有CaCO3 , CaCO3能与盐酸反应生成二氧化碳气体,观察到的实验现象是生成的气体二氧化碳进入B,与其中的其中的澄清石灰水反应生成沉淀,反应方程式是CO2+Ca(OH)2=CaCO3↓+H2O;若样品中含有Fe,Fe与盐酸反应生成氢气,氢气到达D装置后还原氧化铜,生成铜和水,反应中黑色粉末变为红色;水蒸气进入E装置,可以看到E中的无水硫酸铜变蓝;(2)据碳酸钙和稀盐酸反应,生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;铁与稀盐酸反应,生成氯化亚铁和氢气,反应的化学方程式为:Fe+2HCl=FeCl2+H2↑;(3)因为小袋上面标有成分:CaO、Fe,其中的CaO可能有部分未变质;可能会吸收空气中的水分,生成Ca(OH)2 , 二者都是灰白色固体,所以灰白色粉末中还应该有CaO或Ca(OH)2 . 了验证该物质的存在,有同学取一部分袋内灰白色粉末加水充分溶解、过滤,再向滤液中滴加酚酞溶液,若液体变红色,则证明了该物质的存在;(4)氧化铁与稀盐酸反应生成氯化铁和水.该反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O;(5)浓硫酸具有吸水性,为防止空气中的水蒸气进入E中,在E装置后增加盛有浓硫酸的洗气瓶.才使实验更有说服力.
所以答案是:(1)澄清的石灰水变浑浊;CO2+Ca(OH)2=CaCO3↓+H2O;黑色固体变成红色;(2)Fe+2HCl=FeCl2+H2↑; (3)Ca(OH)2 ;酚酞溶液;(4)Fe2O3+6HCl=2FeCl3+3H2O;(5)浓硫酸.
【考点精析】本题主要考查了金属材料的选择依据和书写化学方程式、文字表达式、电离方程式的相关知识点,需要掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属;注意:a、配平 b、条件 c、箭号才能正确解答此题.

 阅读快车系列答案
阅读快车系列答案