题目内容
工业炼铁的主要反应原理是:Fe2O3++3CO
2Fe+3CO2.在该反应过程中元素的化合价升高的是 元素,元素的化合价降低的是 元素.
| ||
分析:根据单质中元素的化合价为0、在化合物中正负化合价代数和为零,结合涉及的各化学式进行解答本题.
解答:解:氧元素显-2,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可知Fe2O3中铁元素的化合价:2x+(-2)×3=0,则x=+3.
Fe属于单质,铁元素的化合价为0.
氧元素显-2,设碳元素的化合价是y,根据在化合物中正负化合价代数和为零,可知CO中碳元素的化合价:y+(-2)=0,则y=+2.
氧元素显-2,设碳元素的化合价是z,根据在化合物中正负化合价代数和为零,可知CO2中碳元素的化合价:z+(-2)×2=0,则z=+4.
故该反应过程中元素的化合价升高的是碳元素;元素的化合价降低的是铁元素.
故答案为:碳(C);铁(Fe).
Fe属于单质,铁元素的化合价为0.
氧元素显-2,设碳元素的化合价是y,根据在化合物中正负化合价代数和为零,可知CO中碳元素的化合价:y+(-2)=0,则y=+2.
氧元素显-2,设碳元素的化合价是z,根据在化合物中正负化合价代数和为零,可知CO2中碳元素的化合价:z+(-2)×2=0,则z=+4.
故该反应过程中元素的化合价升高的是碳元素;元素的化合价降低的是铁元素.
故答案为:碳(C);铁(Fe).
点评:本题难度不大,考查学生利用化合价的原则计算指定元素的化合价的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列叙述错误的是( )
| A、硝酸铵溶于水使溶液温度升高 | ||||
| B、氢氧化钠固体易吸收空气中的水分而潮解 | ||||
C、氧元素的原子结构示意图为 ,它是第二周期的非金属元素 ,它是第二周期的非金属元素 | ||||
D、工业炼铁的主要反应原理是Fe2O3+3CO
|
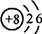
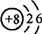 ,它是第二周期的非金属元素
,它是第二周期的非金属元素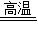 2Fe+3CO2
2Fe+3CO2 ,它是第二周期的非金属元素
,它是第二周期的非金属元素 2Fe+3CO2
2Fe+3CO2