题目内容
【题目】学习了MnO2对过氧化氢分解有催化作用的知识后,某同学想:CuO能否起到类似MnO2的催化剂作用呢?于是进行了以下探究.
(1)【猜想】Ⅰ、CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变;Ⅱ、CuO参与反应产生O2 , 反应前后质量好化学性质发生了改变;
Ⅲ、CuO是反应的催化剂,反应前后 .
(2)【实验】用天平称量0.2gCuO,取5mL5%的过氧化氢溶液于试管中,进行如下实验: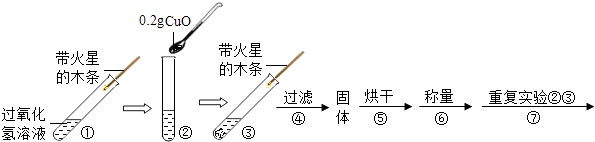
填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦目的 | 结论 |
猜想Ⅰ、Ⅱ不成立;猜想Ⅲ成立. |
(3)步骤①的目的是 .
(4)步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、 .
(5)过氧化氢能被CuO催化分解放出O2的符号表达式为 .
(6)【拓展】影响过氧化氢溶液分解产生氧气的快慢的因素还有(一种即可)
【答案】
(1)质量和化学性质不变
(2)剧烈反应,产生大量气泡;0.2g;带火星木条复燃
(3)与步骤③对比,检验加入氧化铜后双氧水的分解速率是否发生了变化
(4)玻璃棒;
(5)2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
(6)温度升高,过氧化氢溶液分解的速率加快等(合理即可)
【解析】解:(1)Ⅲ、催化剂的特点是“一变,两不变”,即反应速率变,质量和化学性质不变.(2)氧化铜对过氧化氢的分解有催化作用,能加快其分解速率生成氧气的速率,故现象是有气泡,带火星的木条复燃;催化剂的特点是“一变,两不变”,反应前后其质量不变,所以氧化铜的质量仍为0.2g;催化剂的特点是“一变,两不变”,其中反应速率改变,这里是加快,所以现象是溶液中有气泡放出,带火星的木条复燃.(3)为了看氧化铜是否能改变反应的速率,要通过加入氧化铜与不加氧化铜的现象进行对比,才能得出科学合理的结论.(4)过滤用到的仪器有:铁架台(带铁圈)、漏斗、烧杯、玻璃棒,缺少最后一种,注意仪器与材料或用品不同.(5)双氧水反应生成水和氧气,过氧化氢能被CuO催化分解放出O2的化学方程式为2H2O2 ![]() 2H2O+O2↑.(6)【拓展】影响化学反应快慢的因素很多,如催化剂二氧化锰能加快双氧水的分解速率,另外反应物的浓度、温度、颗粒大小、接触面积等,也会影响化学反应快慢.所以可做出以下猜想:温度升高,过氧化氢溶液分解的速率加快;或过氧化氢溶液的浓度越大,过氧化氢溶液分解的速率加快等. 所以答案是:(1)Ⅲ、质量和化学性质不变;(2)填表:
2H2O+O2↑.(6)【拓展】影响化学反应快慢的因素很多,如催化剂二氧化锰能加快双氧水的分解速率,另外反应物的浓度、温度、颗粒大小、接触面积等,也会影响化学反应快慢.所以可做出以下猜想:温度升高,过氧化氢溶液分解的速率加快;或过氧化氢溶液的浓度越大,过氧化氢溶液分解的速率加快等. 所以答案是:(1)Ⅲ、质量和化学性质不变;(2)填表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
剧烈反应,产生大量气泡 | 0.2g | 带火星木条复燃 |
3)与步骤③对比,检验加入氧化铜后双氧水的分解速率是否发生了变化;(4)玻璃棒;(5)2H2O2 ![]() 2H2O+O2↑.
2H2O+O2↑.
【拓展】温度升高,过氧化氢溶液分解的速率加快等(合理即可).
【考点精析】掌握催化剂的特点与催化作用和书写化学方程式、文字表达式、电离方程式是解答本题的根本,需要知道催化剂(触媒):在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质.(一变两不变)催化剂在化学反应中所起的作用叫催化作用;注意:a、配平 b、条件 c、箭号.

【题目】实验测得某些食物的近似pH如下,下列说法正确的是( )
食物 | 泡菜 | 葡萄 | 番茄 | 苹果 | 牛奶 | 玉米粥 |
pH | 3.4 | 4.2 | 4.4 | 3.1 | 6.5 | 7.8 |
A.牛奶和玉米粥均属于碱性食物
B.胃酸过多的人应少食泡菜
C.番茄的酸性比苹果强
D.用湿润的pH试纸蘸取葡萄汁测其pH