题目内容
【题目】(10分)南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源。
(1)海水制盐。从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂质,为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a.加过量的Ba(OH)2溶液;b.加稍过量的盐酸;c.加过量的Na2CO3溶液;d.过滤;e.蒸发。正确的操作顺序是 (填字母)。加Na2CO3溶液的作用是除去 。
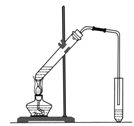
(2)海水淡化。下图是一个简易的蒸馏法淡化海水的装置。证明得到的水是淡水的方法是 。
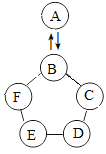
(3)海水制镁。从海水中提取金属镁的过程如下图所示:
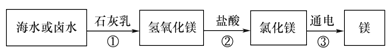
在上述转化过程中发生中和反应的是 (填反应顺序号)。海水中本身就含有氯化镁,则①、②两步的作用是 。
(4)海水“制碱”。氨碱法制纯碱是先通过化学反应生成NaHCO3和NH4Cl,NaHCO3结晶析出,再加热NaHCO3制得纯碱。
①氨碱法制纯碱中生成NaHCO3和NH4Cl的化学方程式为 ;
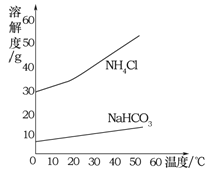
②反应中生成NaHCO3和NH4Cl的质量比为84∶53.5,NaHCO3和NH4Cl的溶解度曲线如图所示。请分析NaHCO3结晶析出而NH4Cl没有结晶析出的原因是 。
【答案】(1)①②③④(2)(3)①②(4)①NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl
②氯化铵的溶解度要远远大于碳酸氢钠的溶解度,而反应生成的碳酸氢钠的质量要大于氯化铵的质量,因此在溶液中碳酸氢钠会因先达到饱和而析出。
【解析】
试题分析:(1)第一步:除去硫酸镁可加入氢氧化钡溶液,产生硫酸钡沉淀和氢氧化镁沉淀。为保证硫酸完全除去需要加入过量的氢氧化钡。第二步:除去氯化钙可加入过量的碳酸钠溶液,形成碳酸钙沉淀。同时还可除去第一步中因过量而剩余的钡离子(如先加碳酸钠再加氢氧化钡,则无法除去过量的钡离子);第三步过滤;将泥沙及前两步形成的沉淀除去;第四步:向第三步得到的滤液中加入过量的盐酸,除去每一步剩余的氢氧根离子及第二步剩余的碳酸根离子;第五步:蒸发,得到精盐固体。同时可除去第四步剩余的盐酸(蒸发过程中挥发)。所以操作步骤为:a、c、d、b、e。 加入过量的碳酸钠的作用是除去氯化钙和氢氧化钡。
(2)为证明得到的水是淡水,即其中不含可溶解的盐类物质(主要是氯化钠)可采用蒸干的方法,如蒸干后没有固体,说明得到的水为淡水。也可向得到的水中加入硝酸银,如不产生沉淀,则所得到的水为淡水。如含氯离子,则会产生白色的氯化银沉淀。
(3)①为氯化镁(盐)与氢氧化钙(碱)反应;②为氢氧化镁(碱)与盐酸(酸)的反应;③为氯化镁在通电时发生分解反应生成镁和氯气。中和反应是酸和碱作用生成盐和水的反应,所以符合条件的是②。步骤①可过滤得到纯净的氢氧化镁,步骤②可得到高浓度的氯化镁;所以步骤①②的作用是富集氯化镁。
(4)①氨碱法制纯碱时,氯化钠可与水、氨气、二氧化碳等物质反应生成碳酸氢钠和氯化铵;反应的化学方程式为:NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl
②根据图像可知:氯化铵的溶解度要远远大于碳酸氢钠的溶解度,而反应生成的碳酸氢钠的质量要大于氯化铵的质量,因此在溶液中碳酸氢钠会因先达到饱和而析出。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案