题目内容
【题目】某学习小组用如图所示装置测定铜锌合金中铜的质量分数.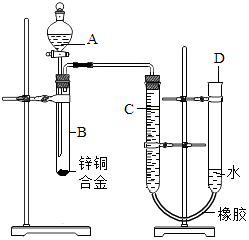
(1)实验前,先将铜锌合金在稀酸中浸泡片刻,其目的是:
(2)实验操作步骤有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥、称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂;⑤检查气密性.上述再进行的操作顺序是(填序号);
(3)若实验用锌铜合金的质量为ag,与稀硫酸充分反应后,测得氢气体积为VL,为求出合金中锌、铜的质量分数,还缺少的一个数据是;
A.反应前加入稀硫酸的体积
B.反应前加入稀硫酸的质量分数
C.实验前反应装置中空气的体积
D.实验条件下氢气的密度
(4)B中发生反应的化学方程式为 .
(5)小明同学认为该装置还可以用来测定石灰石中碳酸钙的质量分数.
①在实验中,若没有植物油,测定结果会(填“偏大”“偏小”或“不变”);
②下列操作中,下列情况不影响测定结果的是(填字母).
A.实验前试管中有空气
B.实验中水准管口有水溢出
C.读数时量气管和水准管液面不相平
D.实验后生成的气体在试管中仍有滞留.
【答案】
(1)除去合金表面的氧化膜
(2)⑤④①③②
(3)D
(4)Zn+H2SO4=ZnSO4+H2↑
(5)偏小;A
【解析】解:(1)实验前,先将锌铜合金在稀酸中浸泡片刻,除去合金表面的氧化膜;(2)要根据排开液体的体积来测定生成氢气的体积,首先需记录C的液面,然后使反应进行,当充分反应时在记下C的位置,最后可以对剩余固体进行处理,所以是⑤④①③②;(3)要求氢气的质量,除了知道氢气的体积,还需要知道氢气的密度,故选:D;(4)锌和硫酸反应生成硫酸锌和氢气,化学方程式为:Zn+H2SO4=ZnSO4+H2↑;(5)①二氧化碳会与水反应,所以在实验中,若没有植物油,测定结果会偏小;
②A.实验前试管中有空气,不会影响二氧化碳的收集,故A正确;
B.实验中水准管口有水溢出,会影响二氧化碳体积的判断,故B错误;
C.读数时量气管和水准管液面不相平,会影响二氧化碳体积的判断,故C错误;
D.实验后生成的气体在试管中仍有滞留,二氧化碳的体积减小,故D错误.
故选:A.
所以答案是:(1)除去合金表面的氧化膜;(2)⑤④①③②;(3)D;(4)Zn+H2SO4=ZnSO4+H2↑;(5)偏小,A.
【考点精析】通过灵活运用二氧化碳的化学性质和金属材料的选择依据,掌握化学性质:一般情况下不能燃烧,也不支持燃烧,不能供给呼吸;与水反应生成碳酸;能使澄清的石灰水变浑浊;与灼热的碳反应;黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属即可以解答此题.