题目内容
【题目】依据实验目的设计切实可行的实验方案是科学探究中的重要环节. 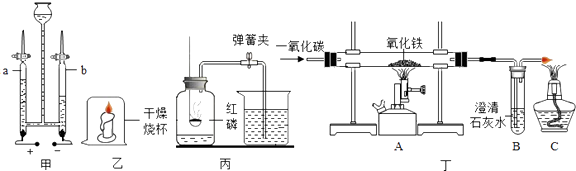
(1)用甲装置电解水,a管中收集到的气体是;开启a管活塞,检验a管中产生气体的方法是 .
(2)用乙装置进行探究实验,观察现象得出结论. ①蜡烛中含有氢元素,依据的现象是 .
②一段时间后蜡烛熄灭,由此得出可燃物燃烧必须具备的条件之一是 .
今年天津8.12化学危险品爆炸事件中,消防员用水灭火导致爆炸,原因之一是金属钠遇水的方程式:2Na+2H2O═2NaOH+X,由此得知该X气体为(填化学式).
(3)用丙装置测定空气中氧气的含量,下列有关该实验的说法中,不正确的是
A.实验时红磷一定要足量
B.点燃红磷前先用弹簧夹夹紧橡皮管
C.燃烧匙中的红磷可以换成木炭
D.红磷熄灭并冷却后打开弹簧夹
(4)早在春秋战国时期,我国就开始生产和使用铁器,工业上炼铁的原理是利用一氧化碳和氧化铁的反应(如图丁所示).能够证明装置A中玻璃管内发生了化学变化的现象是 . 写出一氧化碳还原氧化铁的化学方程式
【答案】
(1)氧气;将带火星的木条放在尖嘴口处,木条能够复燃,则证明是氧气
(2)烧杯内壁有水珠产生;与氧气接触;H2
(3)C
(4)玻璃管内的红色粉末变为黑色;Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
【解析】解:(1)电解水的实验现象:两极都有气泡产生;从电极看出a管产生的气体是b管产生气体体积的二分之一,所以a管中的气体是氧气,b管中的气体是氢气,氢气具有可燃性;开启a管活塞,检验a管中产生气体的方法是将带火星的木条放在尖嘴口处,木条能够复燃,则证明是氧气;(2)证明蜡烛中含有氢元素,可验证蜡烛燃烧生成物中有水来证明;烧杯中蜡烛很快熄灭,是因为烧杯中的氧气耗尽了,说明蜡烛燃烧需要氧气; 根据质量守恒定律,化学反应前后原子的种类和数目不变,反应前Na、H、O的原子个数是2、4、2;反应后Na、H、O的原子个数是2、2、2;由此得知该X气体为H2;(3)A.红磷的量不足不能消耗完瓶内氧气,进入的水减少会影响实验结论;
B.加紧弹簧夹是因为防止燃烧时气体膨胀溢出;
C.由于碳燃烧生成二氧化碳也是气体,所以瓶内压强基本保持不变,所以水不会进入,所以换成碳不行;
D.红磷熄灭并冷却后会使集气瓶中温度恢复到室温,而使实验结论精确;(4)一氧化碳和氧化铁高温反应生成铁和二氧化碳,氧化铁是红色固体,铁粉是黑色固体,所以玻璃管内的红色粉末变为黑色;CO和Fe2O3在高温条件下生成铁和二氧化碳,反应方程式是:Fe2O3+3CO ![]() 2Fe+3CO2;
2Fe+3CO2;
所以答案是:(1)氧气,用带火星的木条放在尖嘴口处,木条能够复燃,则证明是氧气;(2)①烧杯内壁有水珠产生; ②与氧气接触;(3)C;(4)玻璃管内的红色粉末变为黑色;Fe2O3+3CO ![]() 2Fe+3CO2;
2Fe+3CO2;
【考点精析】本题主要考查了电解水实验和一氧化碳还原氧化铁的相关知识点,需要掌握电解水的实验:A.装置―――水电解器B.电源种类---直流电C.加入硫酸或氢氧化钠的目的----增强水的导电性D.化学反应:2H2O=== 2H2↑+ O2↑;原理:在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来才能正确解答此题.