题目内容
实验证明C2O3的化学性质与CO相似,下列关于C2O3的说法错误的是
| A.C2O3属于非金属氧化物 |
| B.C2O3中碳元素的质量分数为33.3% |
| C.C2O3有毒,密度比空气小 |
| D.C2O3不可以使澄清石灰水变浑浊 |
C
解析试题分析:一氧化碳具有毒性;一氧化碳具有还原性,能夺取金属氧化物中的氧而生成二氧化碳;一氧化碳不能使澄清石灰水变浑浊;根据一氧化碳的化学性质,利用三氧化二碳化学性质与一氧化碳相似的提示信息,对选项中的判断进行评价并作出判断即可。A、C2O3的组成中没有金属元素,所以可以判定C2O3为非金属氧化物,故A说法正确;B、C2O3中碳元素的质量分数=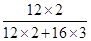 ×100%=33.3%,故B说法正确;C、一氧化碳有毒,所以可以判断C2O3也有毒,但是根据C2O3的相对分子质量为12×2+16×3=72,而空气的平均相对分子质量为29,所以可以判断空气的密度比C2O3的密度小,故C说法错误;D、CO不能使澄清石灰水变浑浊,而三氧化二碳化学性质与一氧化碳化学性质相似,可判断C2O3不能使澄清石灰水变浑浊,故D说法正确,故选C。
×100%=33.3%,故B说法正确;C、一氧化碳有毒,所以可以判断C2O3也有毒,但是根据C2O3的相对分子质量为12×2+16×3=72,而空气的平均相对分子质量为29,所以可以判断空气的密度比C2O3的密度小,故C说法错误;D、CO不能使澄清石灰水变浑浊,而三氧化二碳化学性质与一氧化碳化学性质相似,可判断C2O3不能使澄清石灰水变浑浊,故D说法正确,故选C。
考点:考查一氧化碳的化学性质;元素的质量分数计算

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案Sb2O5是一种重要的阻燃剂。用X来生成该阻燃剂的化学方程式为:X+2H2O2=Sb2O5+2H2O。根据质量守恒定律,推断X的化学式为
| A.SbO2 | B.Sb2O3 | C.HSbO3 | D.H3SbO4 |
过氧化钠(Na2O2)因能与二氧化碳反应生成氧气,故可作为呼吸面具中氧气的来源.潜水艇紧急情况时,也使用过氧化钠来供氧,有关反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2.从该反应获取的以下信息中,正确的是( )
①过氧化钠属于氧化物
②该反应属于置换反应
③反应前后氧元素的化合价发生变化
④实验室可利用这一原理制取纯净的氧气.
| A.①③ | B.②④ | C.②③④ | D.①②③ |
某密闭容器中有W、氧气、二氧化碳三种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表,判断下列说法正确的是( )
| 物质 | W | O2 | CO2 | H2O |
| 反应前质量/g | 16 | 72 | 2 | 0 |
| 反应后质量/g | 0 | 待测 | 46 | 36 |
A.“待测”数值为6g
B.W一定不是氧化物
C.CO2是反应物,H2O是生成物
D.反应中CO2和H2O质量变化之比为23:18
科学家提出:“硅是未来的石油”,制备粗硅的反应为:SiO2+2C Si+nCO↑.下列说法正确的是
Si+nCO↑.下列说法正确的是
| A.该化学方程式中n=1 | B.该反应为置换反应 |
| C.反应前后原子总数发生变化 | D.硅是地壳中含量最高的元素 |
薄荷醇(化学式为C10H20O)可用于糖果、饮料的香.下列有关薄荷醇的说法正确的是
| A.薄荷醇不属于化合物 |
| B.薄荷醇由10个碳原子、20个氢原子和1个氧原子构成 |
| C.薄荷醇中碳元素、氢元素和氧元素的质量比为10:20:1 |
| D.薄荷醇中碳元素的质量分数约为76.9% |
牙膏中的含氟化合物对牙齿有保护作用,一种氟原子的原子核内有9个质子和10个中子,该原子的核电荷数为
| A.7 | B.9 | C.10 | D.19 |
常用燃烧法测定有机物的组成.现取3.2g某有机物在足量氧气中充分燃烧,生成4.4gCO2和3.6gH2O,则该有机物中( )(相对原子质量:H﹣1;C﹣12;O﹣16)
| A.一定含C,H两种元素,可能含氧元素 |
| B.一定含C,H,O三种元素 |
| C.一定含C,O两种元素,可能含氢元素 |
| D.只含C,H两种元素,不含氧元素 |
地壳中含量最多的金属元素是( )
| A.硅 | B.氧 | C.铝 | D.铁 |